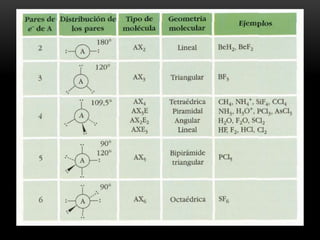
Este documento describe la estructura molecular y los orbitales moleculares. Explica que la geometría molecular depende de la disposición tridimensional de los átomos y cómo afecta a las propiedades de la molécula. También describe cómo los orbitales moleculares, incluyendo los orbitales sigma enlazantes y no enlazantes, dan lugar a los diferentes tipos de enlaces entre átomos y determinan la forma geométrica de las moléculas. Además, explica los modelos de los dobles y triples enlaces y la naturaleza de