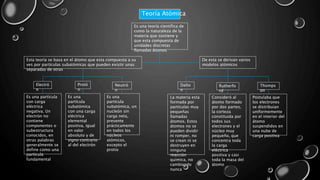
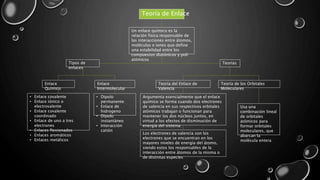
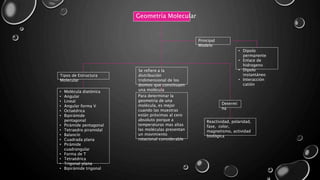
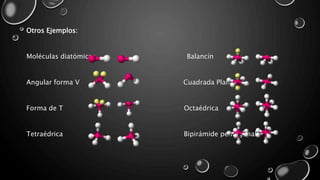
El documento presenta una explicación de cómo las fórmulas geométricas y moleculares se originan a partir de la teoría atómica, teoría de enlace y geometría molecular. Se aborda la relación entre la disposición de los átomos en una molécula y sus propiedades, destacando la importancia de la teoría de repulsión de los pares electrónicos. Además, se discuten ejemplos de estructuras moleculares y su relevancia en el estudio de compuestos químicos.