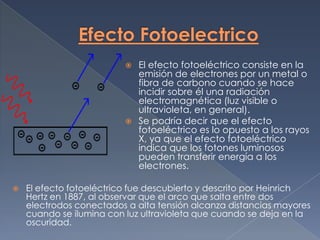
El documento describe varios efectos y descubrimientos fundamentales de la física cuántica como el efecto fotoeléctrico, el efecto Compton, la dualidad onda-partícula de la materia propuesta por De Broglie, el principio de incertidumbre de Heisenberg y la hipótesis de cuantización de la energía de Planck. También se mencionan modelos atómicos como el de Bohr y las propiedades de los espectros de emisión y absorción atómicos.