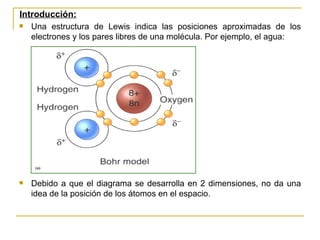
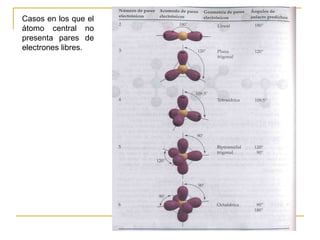
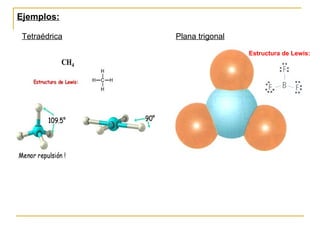
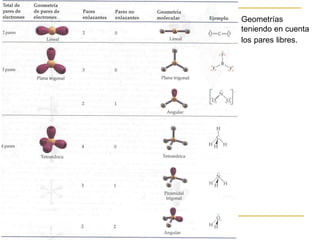
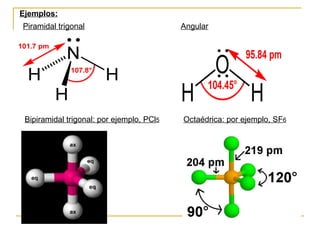
Este documento describe dos modelos para representar la estructura molecular: el diagrama de Lewis y el modelo de repulsión del par electrónico del nivel de valencia (RPENV). El diagrama de Lewis muestra las posiciones aproximadas de los electrones y pares libres pero no la posición espacial de los átomos. El modelo RPENV surge para representar la posición espacial basándose en que los electrones se ubican lo más alejados posible debido a la repulsión. Este modelo tiene en cuenta el número de pares electrónicos del átomo central para de