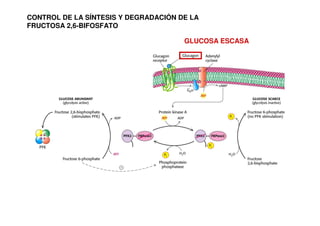
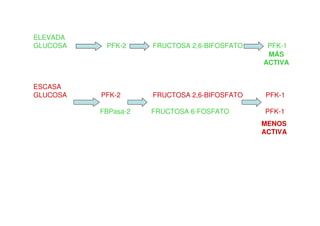
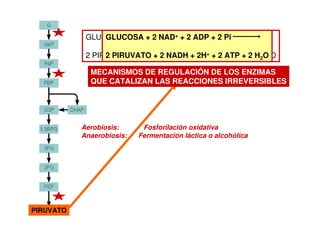
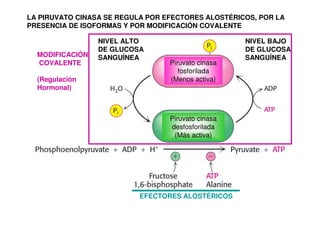
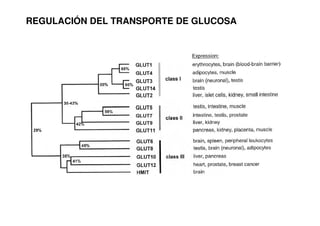
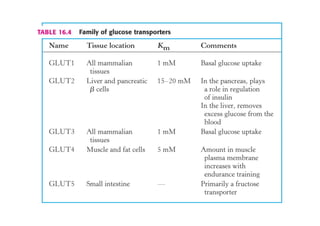
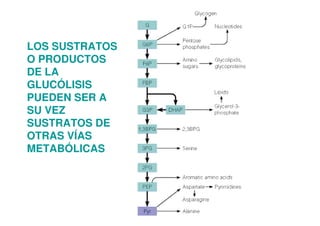
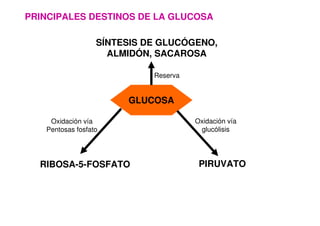
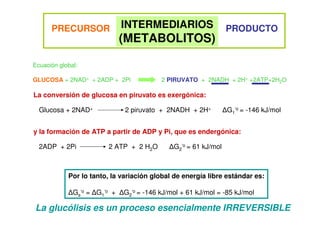
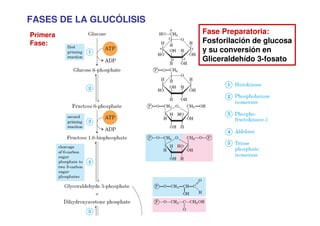
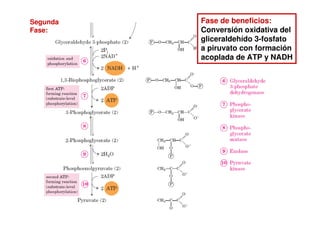
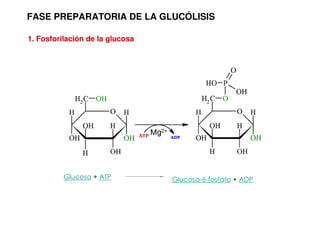
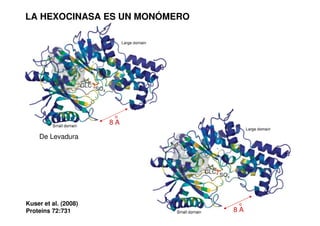
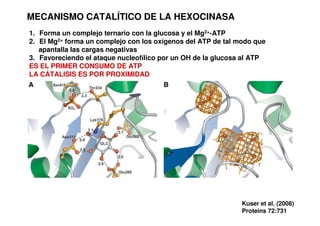
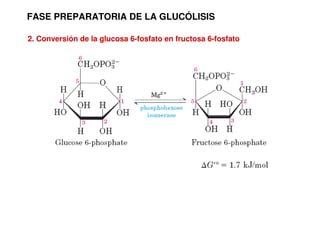
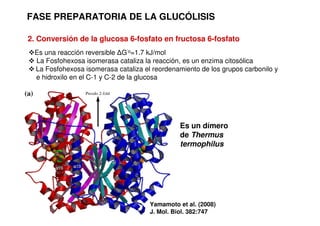
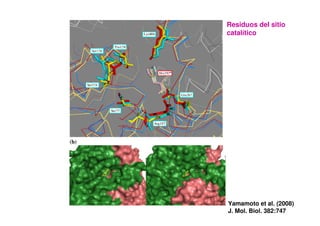
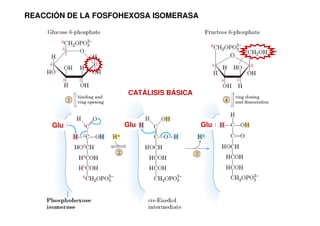
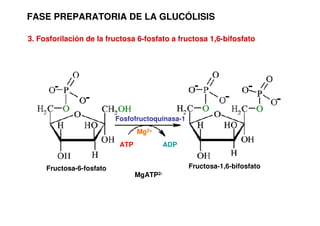
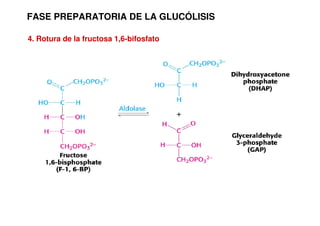
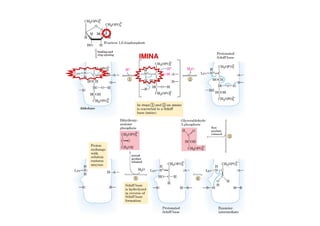
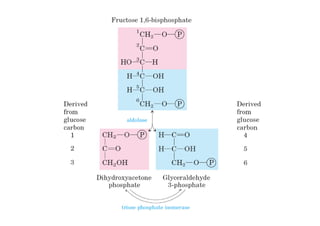
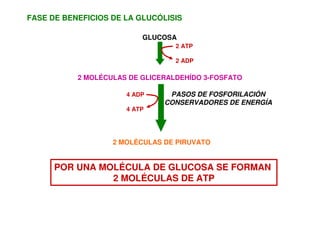
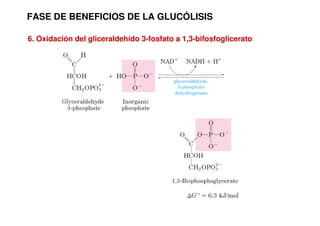
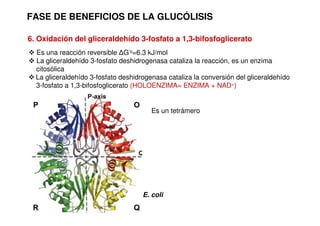
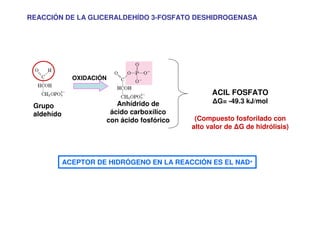
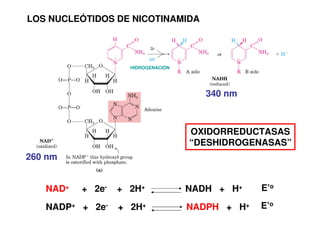
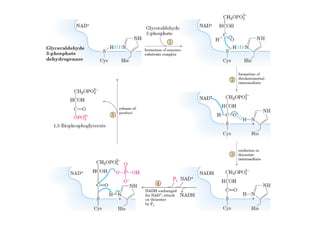
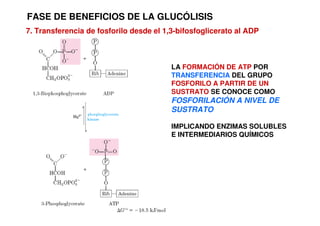
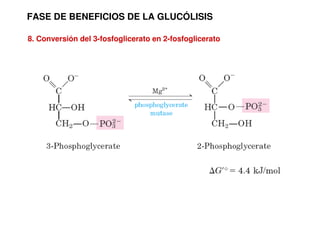
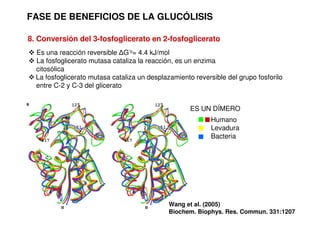
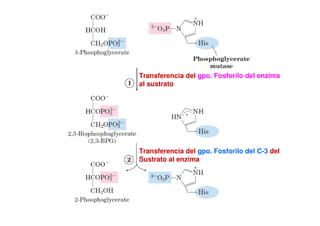
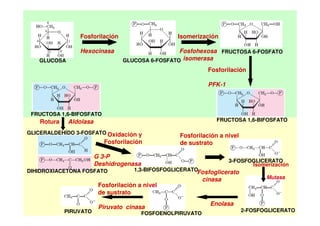
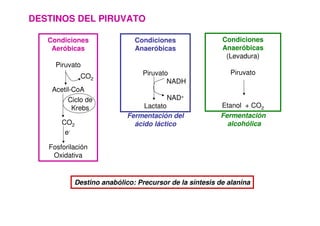
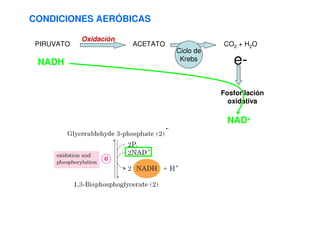
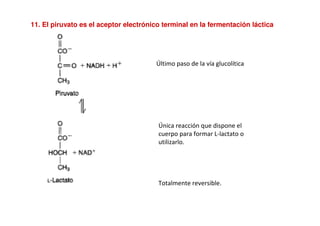
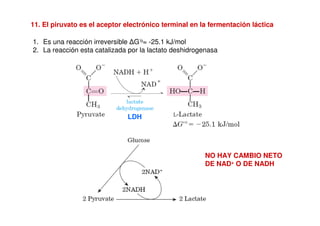
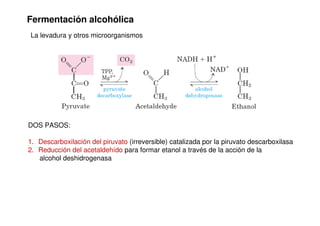
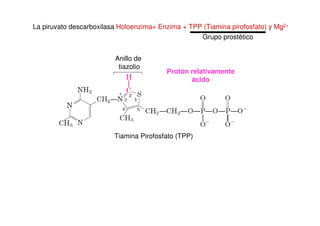
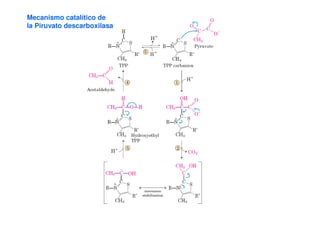
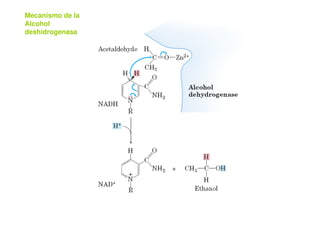
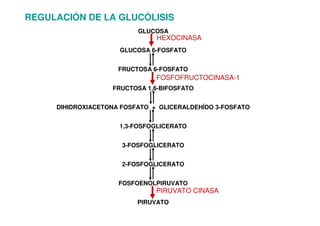
Este documento describe las diez reacciones de la glucólisis divididas en dos fases. La fase preparatoria incluye la fosforilación y conversión de la glucosa en dos moléculas de gliceraldehído-3-fosfato. La fase de beneficios incluye las reacciones oxidativas que convierten las moléculas de gliceraldehído en dos moléculas de piruvato con la formación acoplada de dos moléculas de ATP y NADH. El documento también explica los enzimas y mecanism







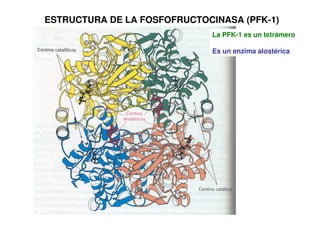
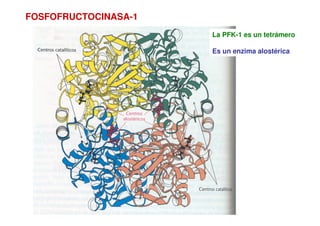
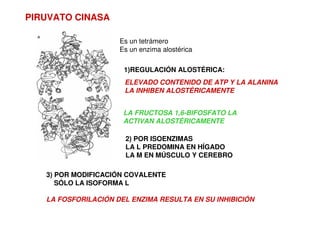
![La PFK-1 es un tetrámero
Es un enzima alostérica
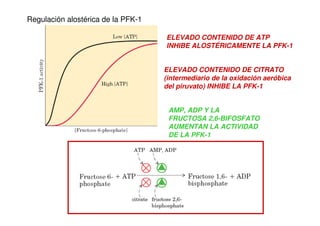
(ATP ES UN MODULADOR
ALOSTÉRICO NEGATIVO)
[ATP] DISMINUYE
AUMENTO EN LA ACTIVIDAD
DE LA PFK-1
Schirmer et al. (1990)
Nature 343:6254](https://image.slidesharecdn.com/glucolisis-220316153958/85/Glucolisis-21-320.jpg)










![HEXOCINASA
ES UN MONÓMERO
REGULACIÓN
ALOSTÉRICA
ES INHIBIDA POR SU PRODUCTO,
LA GLUCOSA 6-FOSFATO
POR LA PRESENCIA DE
4 ISOENZIMAS (I A IV)
HEXOCINASA I A III EN MÚSCULO KM= 0.1 mM
HEXOCINASA IV EN HÍGADO GLUCOCINASA KM= 10 mM
UNA BAJA [GLUCOSA] ES UTILIZADA POR MÚSCULO
UNA ELEVADA [GLUCOSA] ES UTILIZADA POR EL HÍGADO](https://image.slidesharecdn.com/glucolisis-220316153958/85/Glucolisis-61-320.jpg)