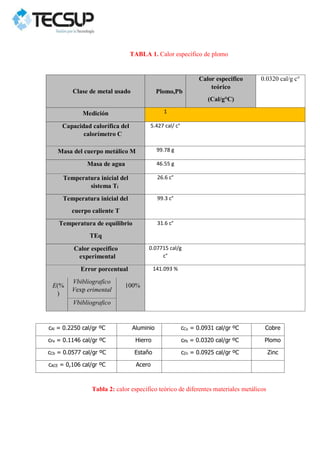
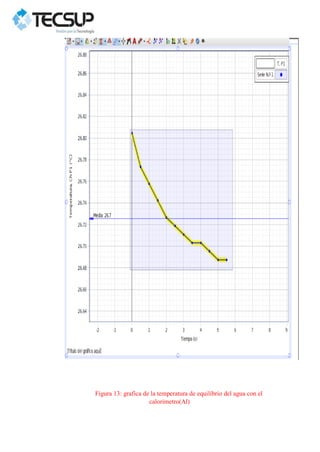
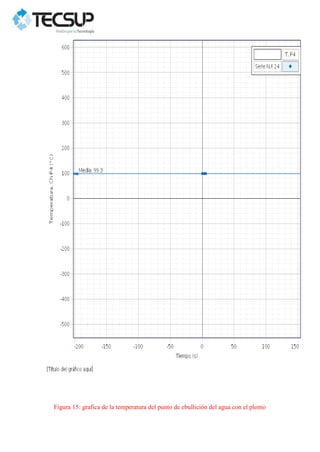
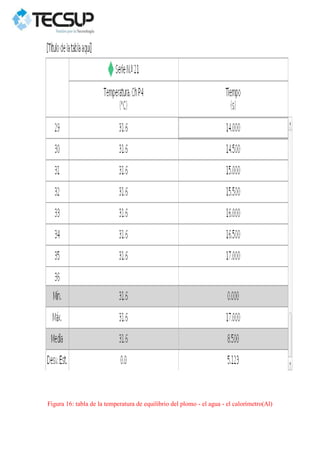
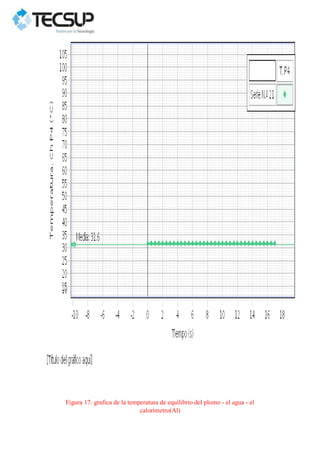
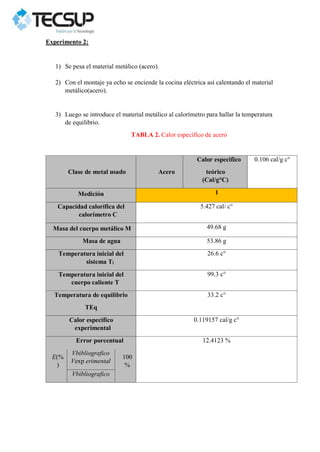
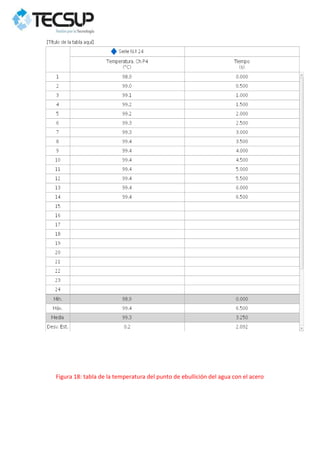
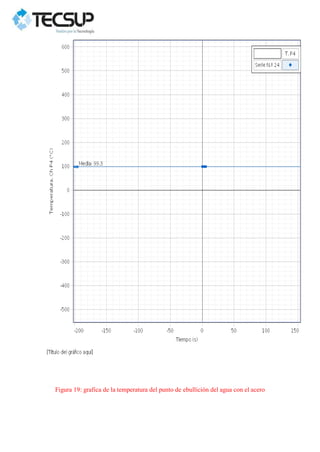
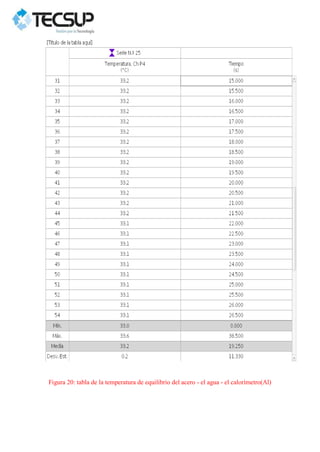
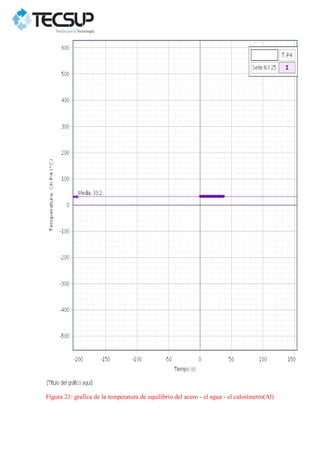
Este documento describe dos experimentos realizados para determinar el calor específico de dos metales sólidos, el plomo y el acero. En cada experimento, se calienta la muestra metálica y se introduce en un calorímetro con agua. Se mide la temperatura de equilibrio y se calcula el calor específico experimental, obteniéndose valores mayores que los teóricos debido a errores en la medición. Los resultados se analizan gráficamente usando el programa PASCO Capstone.