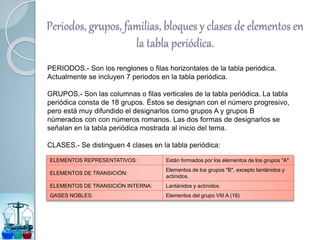
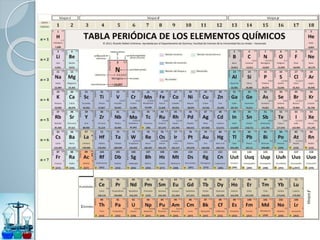
Este documento presenta un resumen de la teoría atómica a través de la historia. Comenzó con la escuela atomista en el siglo V a.C. que propuso que la materia estaba compuesta de átomos indivisibles. Más tarde, en el siglo XIX, Dalton formuló la teoría atómica moderna basada en experimentos sobre gases. Finalmente, la mecánica cuántica del siglo XX explicó la estructura atómica a nivel subatómico usando números cuánticos.