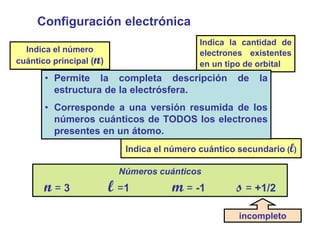
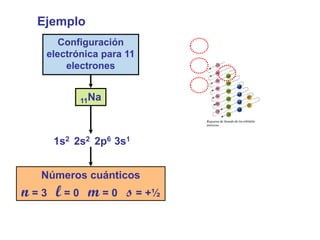
Este documento presenta los conceptos fundamentales de la configuración electrónica, incluyendo los números cuánticos n, l, m y s que describen la posición de los electrones en un átomo, así como las reglas para llenar los orbitales atómicos de acuerdo con su energía. Explica que los números cuánticos determinan la energía, forma, orientación y otros parámetros de los electrones, y que la configuración electrónica resume la distribución de todos los electrones en un átomo.