El documento describe las bases fisiológicas del aparato digestivo humano. Explica que el aparato digestivo se extiende desde la boca hasta el ano y tiene la función de digerir los alimentos, absorber los nutrientes y eliminar los restos no digeridos. Describe las diferentes partes del tracto gastrointestinal como la boca, esófago, estómago, intestino delgado e intestino grueso, así como órganos auxiliares como el hígado y el páncreas. Explica las funciones de cada parte y los procesos de







































































































































![MÓDULO II: VALORACIÓN DEL ESTADO NUTRICIONAL
TEMA XII: EVALUACIÓN CLÍNICA NUTRICIONAL
138
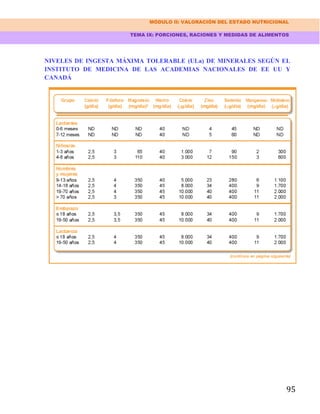
La unificación de los criterios en la medición de los pliegues permite la comparación de los
estudios realizados y contribuye a reducir la variabilidad interobservador, y por ello a aumentar la
fiabilidad de estos estudios.
Se han descrito fórmulas matemáticas, específicas según el sexo y diversos tramos de edad, que
relacionan los pliegues subcutáneos con la densidad corporal total y con el porcentaje de grasa
corporal. La fórmula más conocida es la de Siri:
% grasa corporal = [(4,95/D) - 4,5] x 100
En la que D representa la densidad corporal obtenida por la fórmula de Durnin-Womersley, que
usa los valores obtenidos de la suma de los cuatro pliegues cutáneos mencionados:
D = C - M x log (PT + PB + PS + PA)
C y M son dos coeficientes que fueron publicados por Durnin y Womersley en 1974, según la
edad y el sexo d l paciente, pero en general se emplean los siguientes valores:
C = 1,1143 en hombres y 1,1278 en mujeres
M = 0,0618 en hombres y 0,0775 en mujeres
El valor obtenido en la fórmula de Siri se multiplica por el peso del paciente, y se obtiene el peso
de la MG, que restada del peso corporal total nos permite conocer el valor de la MLG.](https://image.slidesharecdn.com/manualdenutricionamarante-130911223956-phpapp01/85/Manual-de-nutricion-amarante-138-320.jpg)

![MÓDULO II: VALORACIÓN DEL ESTADO NUTRICIONAL
TEMA XII: EVALUACIÓN CLÍNICA NUTRICIONAL
140
circunferencia braquial se determina en la misma localización que el pliegue tricipital, usando
una cinta métrica que rodea el perímetro del brazo no dominante; este valor se emplea en una
fórmula que usa unos coeficientes de corrección:
Hombres: AMB = [(Cb - pT2/4p)] - 10
Mujeres: AMB = [(Cb - pT2/4p)] - 6,5
Donde AMB significa área muscular braquial, Cb es la circunferencia muscular braquial
determinada por el observador, y T el valor del pliegue tricipital medido. Los factores de
corrección respecto a las fórmulas previas se introducen debido a que se observaron
supravaloraciones al comparar estos valores musculares con los estimados por tomografía axial
computarizada (TAC).
En la valoración de los pacientes con sobrepeso, se emplea en la actualidad un parámetro
antropométrico llamado índice cintura/cadera, que resulta de dividir la medida de la
circunferencia, obtenida con una cinta métrica, a nivel de la cintura por la medida a nivel de la
cadera.
Ambas medidas deben realizarse con el paciente en bipedestación, siendo la medida de la cintura
la obtenida en el nivel medio entre los márgenes costales inferiores y las crestas iliacas al final de
haber realizado una espiración; la medida de la cadera es la mayor circunferencia que se obtiene a
nivel de los trocánteres mayores.
Debido a los datos que indican que la distribución de la grasa corporal es un factor importante en
el riesgo de aparición de ciertos procesos patológicos, como la diabetes y enfermedad
cardiovascular, se emplea el índice cintrura/cadera para establecer la distribución de grasa
corporal, habiéndose establecido, a través de diversos estudios epidemiológicos, como puntos de
corte a partir de los cuales se observa un incremento del riesgo, un valor de índice cintura/cadera
superior a 1 en varones y superior a 0,9 en mujeres.
Otros estudios encuentran que la circunferencia de cintura se correlaciona mejor que el índice
cintura/cadera con diversas alteraciones metabólicas que ocurren en el contexto de la obesidad.
La medida de la cintura es hoy día una medida antropométrica imprescindible en la valoración el
paciente obeso, independientemente del IMC, ya que el aumento de la circunferencia se
correlaciona específica y directamente con el contenido de grasa abdominal y en particular con la
grasa visceral. Valores por encima de 88-90 cm en mujeres y por encima de 100-102 cm en
varones son considerados como indicadores de factor de riesgo independiente del grado del
sobrepeso. Sin embargo, no existe un acuerdo unánime entre los diferentes consensos y guías de
práctica clínica para establecer el punto de corte.](https://image.slidesharecdn.com/manualdenutricionamarante-130911223956-phpapp01/85/Manual-de-nutricion-amarante-140-320.jpg)







![MÓDULO III: NUTRICIÓN EN SITUACIONES FISIOLÓGICAS
TEMA XV: GESTACION Y LACTACION
148
antagonizar los efectos de la insulina, mantener el flujo de nutrientes hacia el feto y,
conjuntamente con la prolactina, promover el crecimiento de la glándula mamaria.
Las hormonas esteroideas afectadas son de tres tipos: la progesterona, los estrógenos y el cortisol.
Estas sustancias comienzan a sintetizarse de forma importante a partir de la décima semana de
gestación, y sus concentraciones ascienden progresivamente hasta alcanzar un nivel máximo en el
momento del parto. La concentración más elevada en el plasma es la del cortisol; y el menor
nivel, el de los estrógenos. Todas estas hormonas representan un papel muy importante en el
mantenimiento del ambiente intrauterino adecuado y en el desarrollo de la placenta.
Además, la progesterona tiene otras funciones muy importantes durante la gestación, como son la
de estimular la respiración materna y relajar el músculo liso que se localiza en el útero y en el
tracto gastrointestinal. Igualmente actúa como hormona supresora inmunológica de la placenta,
así como promotora del desarrollo lobular en la mama y como responsable de la inhibición de la
secreción láctea durante la gestación.
En el embarazo, los niveles elevados de estrógenos [E1 (estrona), E2 (estradiol) y E3 (estriol)]
estimulan el crecimiento uterino al incrementar el flujo de sangre hacia este órgano; promueven
el crecimiento de las células somatotrofas en la hipófisis, que se diferencian en células
productoras de prolactina, las cuales desempeñan un papel fundamental en el desarrollo de la
glándula mamaria; y, al finalizar el embarazo, inician y mantienen la producción láctea.
Por último, la elevación plasmática del cortisol ejerce un efecto gluconeogénico al estimular la
producción de glucosa a partir de los aminoácidos.
Los cambios que ocurren en el metabolismo durante la gestación. Durante el anabolismo
materno, los triglicéridos se almacenan como tejido graso, y la glucosa puede metabolizarse hasta
triglicéridos en el tejido adiposo o como glucógeno en el músculo, o bien pasar directamente al
feto; pero durante el catabolismo materno, los triglicéridos de las reservas de grasa liberan ácidos
grasos libres que son consumidos por el músculo, en tanto que la glucosa permanece sin cambios.
Durante la primera mitad de la gestacion, la elevacion de los estrogenos y la progesterona
estimula a las celulas ƒÀ del pancreas, las cuales responden aumentando la secrecion de insulina,
que a su vez aumenta los efectos hormonales sobre el metabolismo de los hidratos de carbono
durante la gestacion.
Efectos hormonales sobre el metabolismo de los lípidos durante la gestación.
Depósitos de glucógeno y la utilización periférica de glucosa, y disminuye la producción
intrínseca de glucosa por el hígado todo lo cual da lugar a cambios anabólicos; y durante la
segunda mitad del embarazo, al aumento de lactógeno placentario, prolactina y cortisol, se induce](https://image.slidesharecdn.com/manualdenutricionamarante-130911223956-phpapp01/85/Manual-de-nutricion-amarante-148-320.jpg)

























































![MÓDULO III: NUTRICIÓN EN SITUACIONES FISIOLÓGICAS
TEMA XVII: PREESCOLAR Y ESCOLAR
206
precisas que le ayuden a la hora de detallar el registro, será capaz de realizarlo, por sí solo o con
ayuda de sus padres. El recuerdo de 24 horas quizás sea el método más utilizado, ya que es rápido
y cómodo de cumplimentar; consiste en definir y cuantificar todas las comidas y bebidas
ingeridas el día anterior a la entrevista. El cuestionario de frecuencia de consumo de alimentos
consiste en una lista cerrada de alimentos sobre la que se solicita la frecuencia de consumo de
cada uno de ellos. Este último tipo de encuesta no permite saber con precisión la cantidad exacta
de alimentos o principios inmediatos ingeridos; sin embargo, es la más usada para conocer el
número de porciones o de veces por día, semana o mes que los adolescentes de un sexo y edad
determinados consumen un alimento o grupo de alimentos en concreto, contrastando los
resultados con las recomendaciones generales para dicha edad.
Exploración clínica y antropometría
La detección de signos clínicos es más fácil en aquellos individuos en los que la situación
nutricional es claramente anormal; sin embargo, algunos de ellos pueden observarse incluso en
individuos supuestamente normales. La valoración nutricional por signos físicos se basa en la
observación de aquellos cambios clínicos relacionados con una ingesta dietética inadecuada,
mantenida en el tiempo, y que pueden detectarse en tejidos epiteliales superficiales, en especial
en la piel, pelo y uñas; en la boca, en la mucosa, lengua y dientes; o en órganos y sistemas
fácilmente asequibles a la exploración física tales como el tiroides o el esqueleto.
La exploración antropométrica o mediciones corporales (peso, talla, perímetro del brazo,
perímetro de la cintura y pliegues cutáneos bicipital, tricipital, subescapular y suprailíaco), así
como los índices calculados a partir de estos [ejemplo: índice de masa corporal (IMC):
peso/talla2, etc.], se utilizan para la determinación del estado de nutrición también en
adolescentes. De manera específica, en este grupo de edad y para cada sexo, se recomienda que
los parámetros se pongan en relación con el grado de maduración sexual o con la edad ósea, más
que con la edad cronológica. Entre los sujetos de una misma edad cronológica puede haber
amplias diferencias antropométricas según el grado de maduración en el que se encuentren.
Como ya se ha comentado en el apartado referente a la composición corporal del adolescente,
tanto en varones como en mujeres, esas variaciones dependen en gran medida del desarrollo
hormonal sexual.
Requerimientos nutricionales durante la adolescencia
La nutrición, especialmente durante la adolescencia, tiene gran importancia en la regulación del
crecimiento y mineralización del esqueleto. Su papel se debe considerar doble, ya que por una
parte proporciona los nutrientes necesarios para el suministro de energía y la formación de
estructuras y, por otra, interactúa con hormonas responsables del crecimiento y maduración,
como la hormona del crecimiento y las gonadotropinas, que a su vez determinan los niveles de](https://image.slidesharecdn.com/manualdenutricionamarante-130911223956-phpapp01/85/Manual-de-nutricion-amarante-206-320.jpg)




































































































![MODULO VI: NUTRICIÓN EN SITUACIONES PATOLÓGICAS
TEMA XXI: ENFERMEDADES DE LOS RIÑONES
307
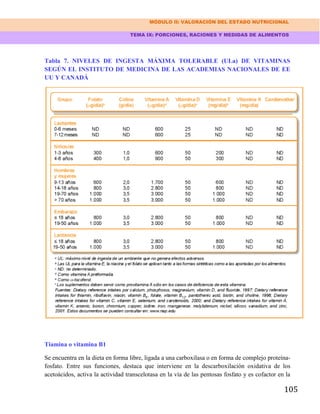
VALORACIÓN SUBJETIVA DEL ESTADO NUTRICIONAL
A. Bien nutrido (restricción de ingesta ausente o mínima, cambios mínimos en función, peso
estable o incrementado)
B. Moderadamente desnutrido (reducción de ingesta, algunos cambios funcionales, cambio de
masa corporal ausente o escaso)
C. Gravemente malnutrido (evidente descensos de ingesta, función y masa corporal) Modificado
de Detsky AS, McLaughin JR, Baker JP, et al. What is subjective global assessment of nutrtional
status? J Parenter Enterol Nutr 1987; 11: 8.
ADDENDUM 2. ALGUNOS PARÁMETROS ANTROPOMÉTRICOS ÚTILES EN LA
EVALUACIÓN Y TERAPÉUTICA NUTRICIONAL
Los valores de los parámetros que se citan, una vez obtenidos en un paciente dado, deben
compararse con los que constan en Tablas de Valores Normales para la población general.
1. Evaluación del estado nutricional global
• Indice de masa corporal = Peso (Kg) / Estatura (m) 2
• Cociente peso / estatura = Peso (Kg) / Estatura (cm)
• Circunferencia de la zona media del brazo (CMB) (mm)
Se mide con una cinta métrica la circunferencia del brazo en el punto medio de su eje
longitudinal.
2. Evaluación de los depósitos de grasa
• Pliegue subcutáneo tricipital (PSCT) (mm) Se mide con un calibrador específico en la zona
media de la región tricipital del brazo.
3. Evaluación de la masa magra corporal (proteínas somáticas)
• Indice creatininaestatura =
Excreción urinaria de creatinina en 24 horas Valor ideal para edad y estatura La creatinina
urinaria se expresa en mg/24 h Existen tablas normalizadas con valores ideales para edad y
estatura
• Área muscular de la zona media del brazo (mm) 2
= [CMB (mm) p PSCT (mm)] 2 4p
• Circunferencia muscular de la zona media del brazo = CMB (mm) [p PSCT (mm)]
• Fuerza de cierre del puño (evaluación muscular funcional)*](https://image.slidesharecdn.com/manualdenutricionamarante-130911223956-phpapp01/85/Manual-de-nutricion-amarante-307-320.jpg)







![MODULO VI: NUTRICIÓN EN SITUACIONES PATOLÓGICAS
TEMA XXI: ENFERMEDADES DE LOS RIÑONES
315
Objetivos del soporte nutricional en el fracaso renal agudo
El soporte nutricional debe ser precoz para limitar el catabolismo proteico, evitar la aparición de
desnutrición, disminuir el número de complicaciones y mejorar el estado nutricional con vistas a
posibles acciones futuras (depuración extrarrenal o trasplante renal).
Su formulación debe tener en cuenta las limitaciones de volumen para evitar la sobrehidratación.
El grado de catabolismo y la presencia o ausencia de un adecuado débito urinario determinan el
tipo de tratamiento. A su vez, el tipo de tratamiento (conservador o depuración extrarrenal) y el
grado de catabolismo determinan la cuantía y naturaleza de los aportes de sustratos.
Teóricamente, un adecuado aporte nutricional debiera mejorar la evolución del fracaso renal. En
individuos sanos, el aporte de proteínas y de aminoácidos incrementa la tasa de filtración
glomerular y el flujo renal, con mayores diuresis y natriuresis, estando involucrados el IGF-1, el
glucagón, las prostaglandinas y el óxido nítrico. No obstante, en el fracaso renal agudo, la
sobrecarga de nitrógeno induce acúmulo de restos nitrogenados, lo que puede deteriorar la
función renal. Aumenta el flujo a las nefronas no lesionadas, con aumento de las presiones
transcapilares y mayor grado de esclerosis.
Soporte nutricional en el fracaso renal agudo no hipermetabólico
El catabolismo proteico es determinante a la hora de establecer el soporte nutricional. La
degradación proteica debe calcularse por el balance de nitrógeno, o por la aparición de nitrógeno
ureico (ANU) si el paciente está sometido a alguna técnica de depuración, o por el grado de estrés
metabólico.
La aparición de nitrógeno ureico correspondeal nitrógeno ureico que se elimina (orina, dializado,
drenajes, etc.) más el cambio que se produce en el nitrógeno ureico corporal.
Figura 2. Factores determinantes en el aporte de sustratos en el fracaso renal.
Gasto total de nitrógeno (g/d) = [0,97 x ANU (g/d)] + 1,93 ANU (g/d) = NUU (g/d) + NUD (g/d)
+ CU (g/d) CU (g/d) = {[NUSa - NUSi (g/d)] x 0,6 Pi (kg)} + {[Pa - Pi (kg)] x NUSa (g/l)}
donde ANU: aparición de nitrógeno ureico; NUU: nitrógeno ureico urinario; NUD: nitrógeno
ureico en líquido de diálisis; CU: cambios en el pool de urea orgánica; NUSa: nitrógeno ureico en
sangre actual; NUSi: nitrógeno ureico en sangre inicial; Pa: peso actual en kg; Pi: peso inicial en
kg; 1,93: pérdidas de nitrógeno no ureico.](https://image.slidesharecdn.com/manualdenutricionamarante-130911223956-phpapp01/85/Manual-de-nutricion-amarante-315-320.jpg)

















































