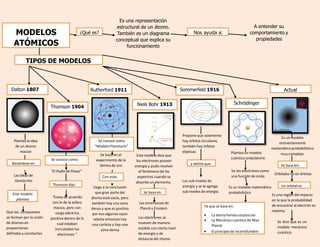
Los modelos atómicos son representaciones estructurales que explican el comportamiento de los átomos, desde el modelo de esfera maciza de Thomson hasta el modelo cuántico ondulatorio de Schrödinger. Estos modelos han evolucionado, incorporando conceptos de energía y probabilidad, y se fundamentan en teorías de destacados científicos como Bohr y Planck. A lo largo de la historia, las ideas sobre la estructura atómica han cambiado, reflejando un avance en la comprensión de la materia.