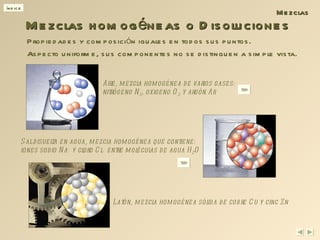
Este documento proporciona una introducción a los conceptos básicos de la materia, incluyendo las clasificaciones de sustancias puras, mezclas y procesos. Define elementos, compuestos, mezclas homogéneas y heterogéneas, y describe algunos métodos para separar mezclas como filtración, destilación y extracción con disolventes.