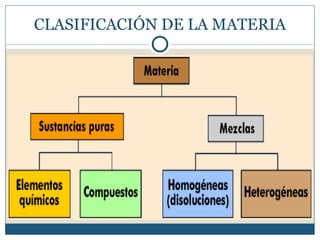
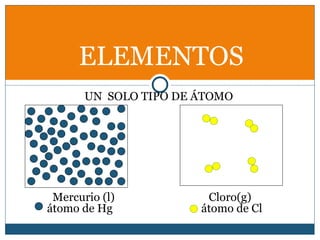
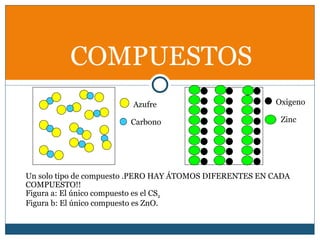
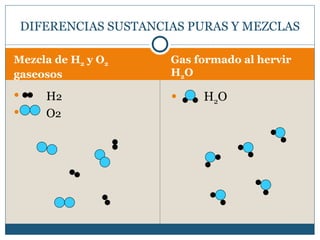
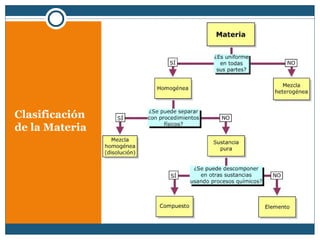
Este documento clasifica la materia en sustancias puras y mezclas. Las sustancias puras se dividen en elementos y compuestos. Los elementos consisten en un solo tipo de átomo, mientras que los compuestos contienen dos o más elementos. Las mezclas pueden ser homogéneas, con la misma composición en toda la muestra, o heterogéneas, con composición variable. Se describen métodos para separar los componentes de sustancias puras y mezclas.