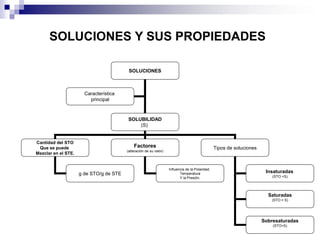
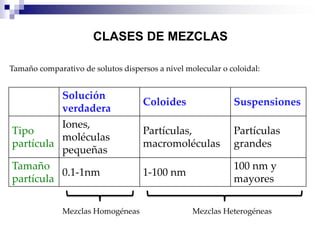
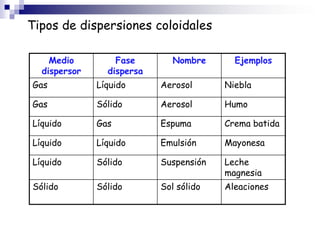
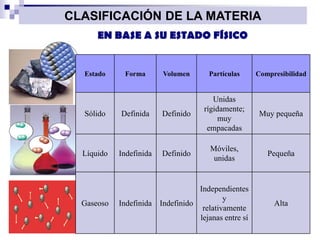
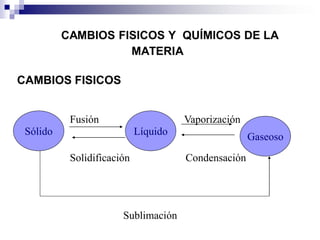
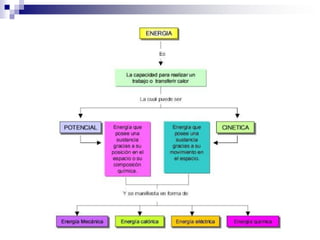
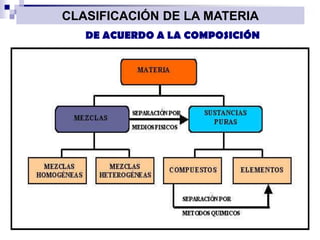
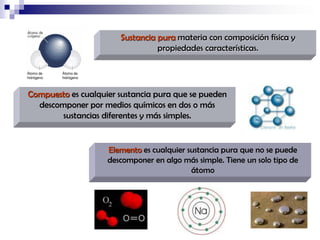
La química estudia la composición, estructura, propiedades y transformaciones de la materia y su energía asociada. La química es importante porque apoya a otras ciencias y permite satisfacer las necesidades humanas en medicina, nutrición y medio ambiente mediante la síntesis de fármacos, alimentos y sustancias para el tratamiento de contaminantes. La materia puede clasificarse como elementos, compuestos, mezclas homogéneas, mezclas heterogéneas, soluciones y sistemas coloidales dependiendo de su composición e




![Disoluciones
Disolvente: componente
mayoritario de la disolución,
que determina si ésta es un
sólido, un líquido o un gas.
Solutos: los demás
componentes de la disolución
Ejemplos:
Disolución de glucosa(sól) en H2O(líq);
glucosa(ac); C6H12O6(ac)
Disolución de metanol(líq) en H2O(líq);
metanol(ac); CH3OH(ac)
Disolución de O2(g) en H2O(líq)
[respiración de peces]
Disolución acuosa de NaCl, KCl, CaCl2 y
C6H12O6
[un suero fisiológico]
7](https://image.slidesharecdn.com/clase01y02qumica-140108214207-phpapp02/85/Clase-01-y-02-quimica-7-320.jpg)