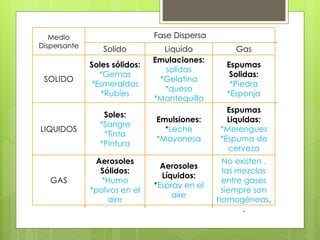
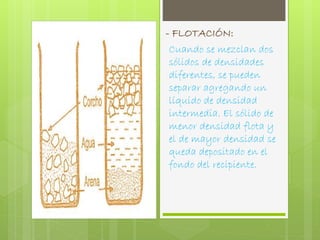
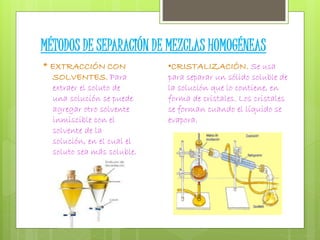
Este documento presenta información sobre mezclas. Describe las características de las mezclas homogéneas y heterogéneas, y proporciona ejemplos de cada tipo. También explica varios métodos para separar mezclas heterogéneas como filtración, flotación y centrifugación, así como métodos para separar mezclas homogéneas como extracción con solventes y cromatografía.