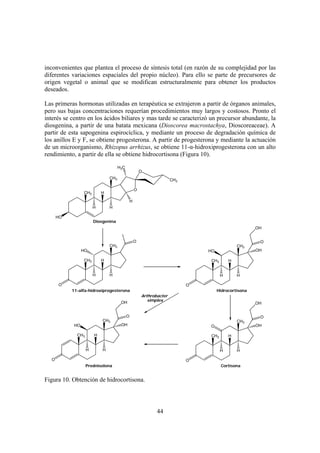
Este documento presenta una introducción a los aspectos básicos de la farmacognosia. Define la farmacognosia como la ciencia que estudia las drogas y sustancias medicamentosas de origen natural, vegetal, microbiano o animal. Explica los conceptos relacionados como droga, planta medicinal, principio activo y medicamento. También describe la taxonomía vegetal y los diferentes niveles taxonómicos, así como ejemplos de clasificaciones. Finalmente, señala que la mayoría de fármacos derivados de fuentes naturales provienen de