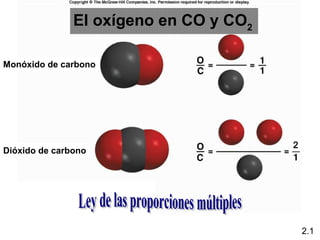
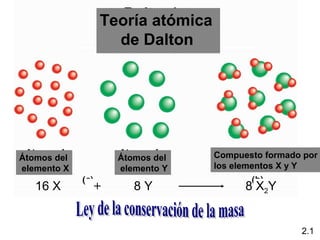
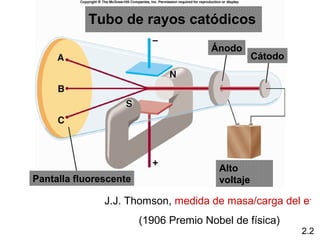
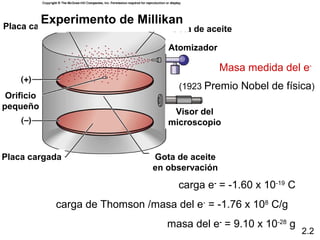
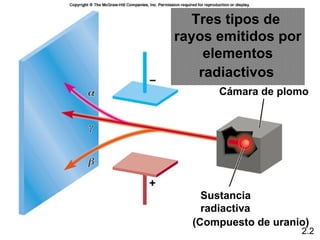
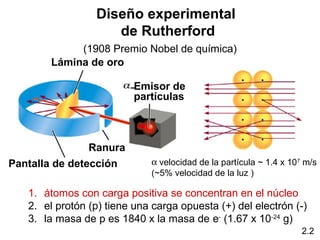
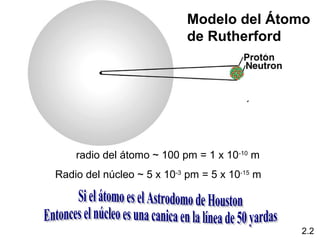
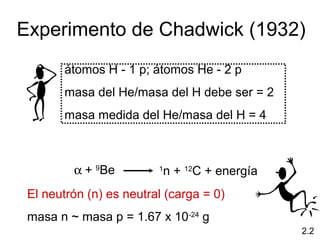
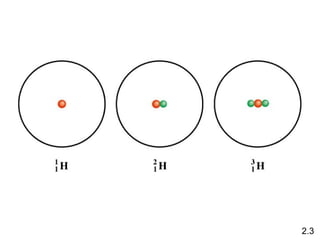
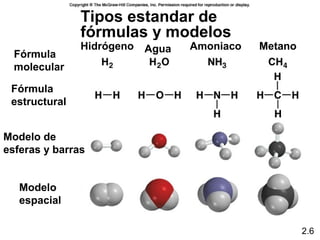
1) El documento describe las teorías atómicas de Dalton y Rutherford, incluyendo la composición del átomo y las partículas subatómicas como protones, neutrones y electrones.
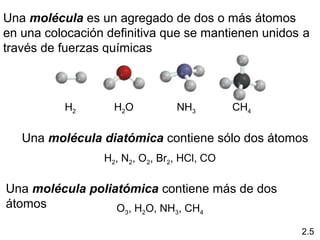
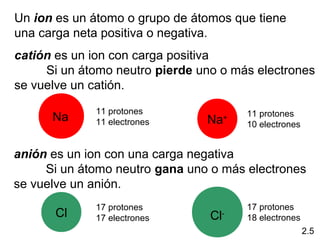
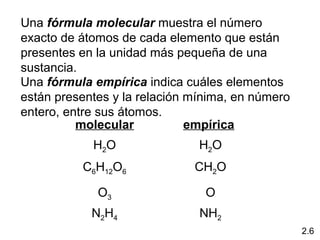
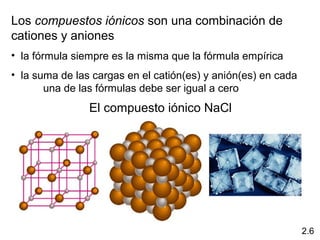
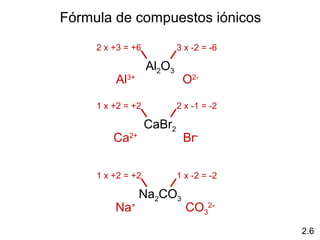
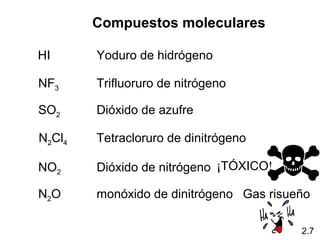
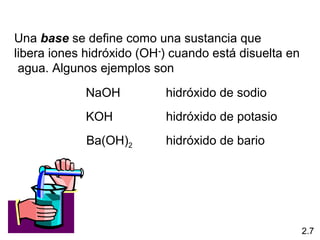
2) Explica la diferencia entre átomos, moléculas e iones, y proporciona ejemplos de cada uno.
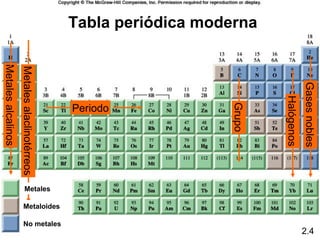
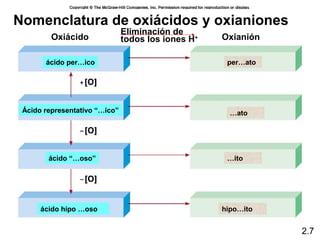
3) Cubre conceptos como números atómicos, masa atómica, isótopos y la tabla periódica.