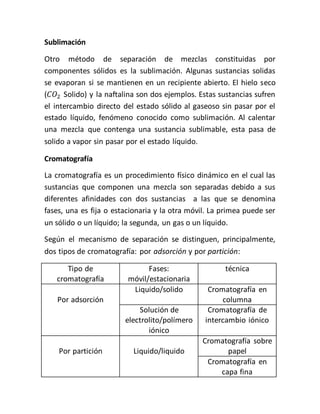
El documento describe diversas prácticas de laboratorio enfocadas en la separación de mezclas utilizando diferentes métodos como decantación, filtración, destilación y cromatografía, destacando la importancia de seguir reglas de seguridad y procedimientos adecuados. También incluye experimentos específicos para aplicar estos métodos, como la obtención de alcohol del tepache y la separación de caseína de la leche. Se enfatiza la necesidad de que los alumnos participen activamente y mantengan el orden y la limpieza en el laboratorio.