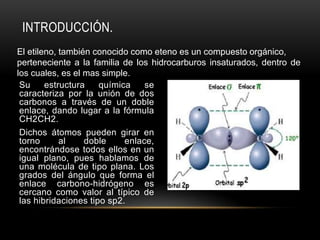
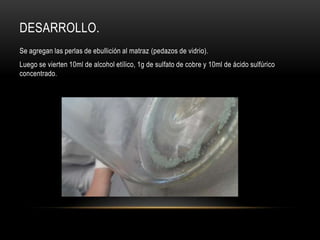
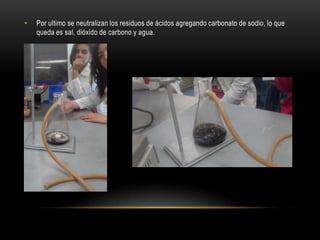
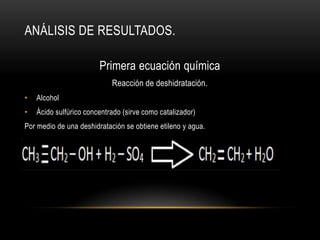
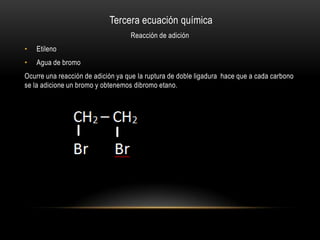
El documento describe cómo obtener etileno a través de la deshidratación de alcohol etílico con ácido sulfúrico concentrado. Se identifica el etileno producido mediante su oxidación con permanganato de potasio y su adición a agua de bromo, lo que cambia el color de las soluciones. El proceso experimental confirma la hipótesis de que el etileno puede ser producido a partir de alcohol etílico con ácido y energía.