Estructura reactividad y transformaciones orgánicas
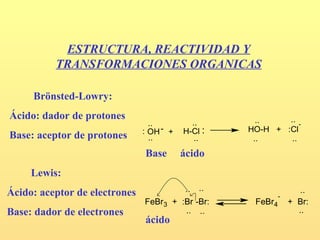
- 1. ESTRUCTURA, REACTIVIDAD Y TRANSFORMACIONES ORGANICAS Brönsted-Lowry: Ácido: dador de protones .. .. - .. .. : OH - + H-Cl : HO-H + :Cl Base: aceptor de protones .. .. .. .. Base ácido Lewis: Ácido: aceptor de electrones .. .. .. - - FeBr3 + :Br -Br: FeBr4 + Br: Base: dador de electrones .. .. .. ácido
- 2. La acidez y basicidad son propiedades relativas de las moléculas. La mayoría de los compuestos orgánicos no son ácidos en medio acuoso. Los enlaces C-H típicos no son fuente de protones en relación al agua como base. ACIDOS CARBOXÍLICOS Y AMINAS Los ácidos carboxílicos son ácidos débiles comunes de la química orgánica con constantes de disociación pequeñas. CH3CO2H + H2O ⇔ CH3CO2- + H3O+ Ka= [CH3CO2-][H3O+] = 1,76*10-5 [CH3CO2H][H2O] ¿Por qué los ácidos carboxílicos son mucho más ácidos que los alcoholes, aún cuando ambos contienen grupos –OH?
- 3. CH3CH2OH + H2O ⇔ CH3CH2O: - + H3O+ alcohol ión alcóxido no estabilizado .. - O :O: :O: + CH3-C + H2O CH3-C CH3-C + H3O .. - O-H :O :O: .. Ácido carboxílico ión carboxilato estabilizado
- 4. ESCALA DE ACIDEZ pKa valoración o pH-metro Acido pKa Base Conjugada 52 Los alcoholes son más ácidos que las aminas y los hidrocarburos menos. .. - Las diferencias pueden ser por la CH3-CH3 50 CH3-CH2- C6H5NH2 27 C6H5NH- electronegatividad del átomo sobre HC≡ CH 25 HC≡ C- el que está unido el protón ácido. (CH3)3COH 18 (CH3)3CO- La naturaleza del medio de CH3OH 15 CH3O- reacción influye sobre la RNH3+ ≈10 RNH2 C6H5OH 10 C6H5O- disociación de los ácidos y bases. CH3CO2H 4.8 CH3CO2- Ej. El agua es un medio favorable ClCH2CO2H 2.9 ClCH2CO2- para el proceso de ionización, CF3CO2H 0.2 CF3CO2- porque tiene una gran capacidad HCl -7.0 Cl- para solvatar aniones y cationes.
- 5. En bases, el pKa→medida de acidez del ácido conjugado. Ka .. CH3N+H3 + H2 O ⇔ CH3NH2 + H3O+ pKa= 10.6 Ión metil amonio metil amina A mayor pKa de ácidos conjugados→más basisidad de las bases correspondientes. pKa = 14- pKb EFECTOS DE LA ESTRUCTURA SOBRE LA ACIDEZ Y LA BASICIDAD Efectos inductivos o electrostáticos Efectos estéricos Efectos de resonancia o conjugación
- 6. EFECTOS INDUCTIVOS Polarización de un enlace por influencia de un grupo. Cl-CH2-CH3 cloroetano Se crea un dipolo permanente El dipolo C-Cl influye sobre el átomo de C vecino mediante un efecto inductivo electrón-atrayente. Los efectos inductivos disminuyen al aumentar la distancia entre los grupos que interaccionan.
- 7. Tabla: Efecto inductivo de los halógenos sobre la acidez. Acido Estructura pKa (H2O) 25ºC Acético CH3COOH 4.76 Yodo acético I CH2COOH 3.12 Cloro acético ClCH2COOH 2.85 4-Cloro butanoico ClCH2CH2CO2H 4.52 Tricloroacético Cl3COO2H 0.7 Trifluoroacético F3COO2H 0.23 Cl CH2-C-OH Cl CH2-C-O- d+ d+ d- d+
- 8. La disociación de un ácido carboxílico es un proceso en equilibrio. Cualquier factor que estabilice el anión carboxilato en relación con el O O ácido carboxílico no disociado, dirigiráGAE equilibrio hacia una CH el CH GDE Se deslocalizará la carga negativa - disociación mayor (mas acidez) O - O GAE GAE GAE GDE -F -CO2H -CO2R -O- Ejemplo: pKa -Cl -OH -C≡N -CH3 CH3CH2CH2COOH 4.8 -Br O -CO2- Cl-CH2CH2CH2COOH 4.5 -C- CH3CHCH2CO2H 4.0 Cl -I + N N Cl -OR CH3CH2CHCOOH 2.9
- 9. EFECTOS ESTERICOS Efectos estructurales que proceden de interacciones especiales entre los grupos. El impedimento estérico a la solvatación puede inhibir la estabilización de la base conjugada. a) CH3CO2H ⇔ CH3CO2- + H3O+ pKa= 5.6 CH3 CH3 CH3 H3C CH3 O CH3 H3C CH3 O H3C CH2 CH H3C CH2 CH + H3O + pKa= 7.0 - CH3 CH3 O OH
- 10. O O b) + H3O + - pKa= 5.05 OH O CH3 CH3 H3C CH3 H3C CH3 O O + + H3O pKa= 6.25 - CH3 OH CH3 O H3C CH H3C CH 3 3 Las aminas muestran un efecto similar en cuanto a la inhibición estérica de la solvatación. .. .. .. (CH3)2NH > CH3NH2 > (CH3)3N Ejercicio:enlace de hidrógeno intramolecular.
- 11. EFECTOS DE RESONANCIA H2O CH3CH2OH ⇔ CH3CH2O: + H3O+ pKa= 16 O O + H3C C H3C C + H 3O pKa= 4.8 - OH O Los alcoholes son 10 veces menos ácidos que los ácidos carboxílicos. El ión carboxilato existe como un híbrido de resonancia. Los dos enlaces carbono oxígeno son iguales. O O O H3C C - H3C C H3C C - - O O O Mayor acidez de ácidos con respecto a los alcoholes puede atribuirse a la deslocalización del par electrónico del ión carboxilato. (base conjugada más estabilizada)
- 12. METODO DE LA RESONANCIA Característica de moléculas en que existen enlaces dobles conjugados. Ejemplo importante de resonancia: pKa= 4.8 A-.Generación de Estructuras Resonantes - Derivan de la aplicación de cálculos mecánico-cuánticos. - Reglas para formular estructuras resonantes: a-. Estructuras resonantes implican el movimiento de electrones y no el de núcleos. CH2=CH-C≡N: ⇔ CH2=CH-C+=N:- ⇔ + CH2-CH=C=N:-
- 13. b- Contribuciones de las estructuras resonantes. El híbrido de resonancia es una única molécula con electrones deslocalizados. (ejemplo: benceno). ¿Por qué el grupo carboxílico no es un híbrido de resonancia? .. - O: O: .. .. H3C H3C .. + .. OH OH .. A B La carga total no varía. La forma (estructura) B no contribuye en forma importante al híbrido de resonancia (separación de cargas) .. .. + - - + H2C O: H2C O: H2C O: .. .. .. Más importante menos importante no importante
- 14. c-. Resonancia Frente a Tautomería Tautomería: sirve para designar la rápida y reversible intercorversión de isómeros (cuando se mueven electrones o uno o más átomos de hidrógeno). O H O HO O O OH H3C C HC C CH3 H3C C CH C CH3 H3C C CH C CH3 Tautomería de la 2,4-pentanodiona O OH H Tautomería de la ciclohexanona La tautomería no debe confundirse con la resonancia. Cada estructura tautómera es capáz de exisitr de forma independiente y pueden ser aisladas.
- 15. ALGUNAS CONSECUENCIAS DE LA RESONANCIA La resonancia es un concepto importante usado para relacionar la estructura con las propiedades químicas. Ejemplo: Estabilización de resonancia del anión carboxilato. a-. Interacciones Entre Grupos Funcionales. H2O CH3CH2-OH ⇔ CH3CH2O:- + H3O+ pKa= 16 H 2O .. .. - + pKa= 10 OH O: + H 3O .. ..
- 16. Los fenoles son más ácidos que los alcoholes porque la base conjugada (ión fenóxido) es estabilizado por resonancia. La carga negativa esta deslocalizada por el anillo bencénico .. - .. .. .. - .. .. - - -: O O: O O O: .. .. .. .. .. :- contribuyente principal Ejemplo: .. - .. .. :O H2O :O .. :O .. + + + - .. + N OH H3O + N O: N O: - - .. :O : - :O : :O : .. .. .. P-nitrofenol Ka= 6*10-8 pKa= 8 La transmisión de efectos electrónicos a través de largos sistemas es una consecuencia importante del fenómeno de la resonancia.
- 17. • Efecto –M Efecto +M • Efecto inductivo positivo, +I • • -CH3 • -NO2 -OH • -CH2CH3 • -CH2CH2CH3 • -COOH -O-R • -CH(CH3)2 • -COOR -NH2 • -C(CH3)3 • -CHO -X (F,Cl,Br,I) • -COO- • R-CO-R • -O- • Efecto inductivo negativo, -I • -NO2 • -CN • -COOH • -F • -Cl • -Br • -I • -OCH3 • -OH
- 18. Carga Formal Número de electrones de valencia que tiene el átomo aislado menos el número de electrones asignado al átomo en la estructura de Lewis. Enlace covalente coordinado: un átomo proporciona dos electrones necesarios para un enlace covalente. Algunos átomos llevan una carga positiva o negativa (carga formal). Estructura más estable - Los átomos deben tener la carga formal más pequeña. - Las cargas negativas deben estar en los átomos más electronegativos. - Las cargas formales no representan cargas reales de los átomos.