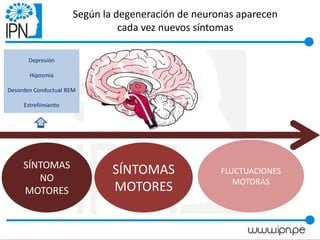
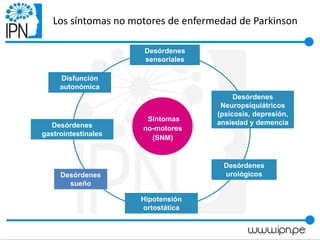
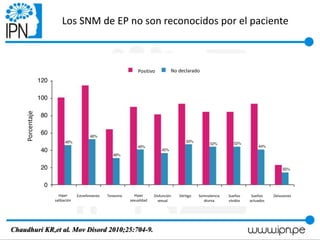
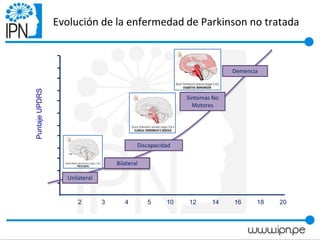
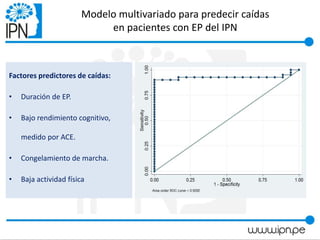
Este documento resume un taller sobre la enfermedad de Parkinson dirigido a pacientes y familiares. El taller discute que la enfermedad de Parkinson no solo afecta a personas mayores, sino también a personas más jóvenes. Explica los síntomas motores como temblores y rigidez, y los síntomas no motores como problemas de sueño e intestinais. También cubre las causas comunes de caídas como la inestabilidad postural y el congelamiento de la marcha. Finalmente, señala que el tratamiento farmacológico no mejor