1. La práctica determinó experimentalmente la capacidad calorífica de un calorímetro y el calor de reacción molar de la neutralización de un ácido y base fuertes.
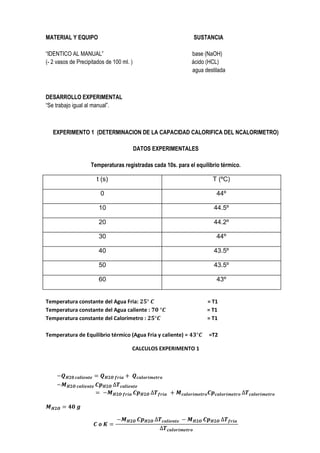
2. Los cálculos incluyeron la capacidad calorífica del calorímetro, las moles de agua formadas, el calor total liberado y el calor de neutralización por mol de agua producida.
3. El calor de neutralización experimental fue 611.9575 kJ/mol, mientras que el valor teórico fue 636 kJ/mol