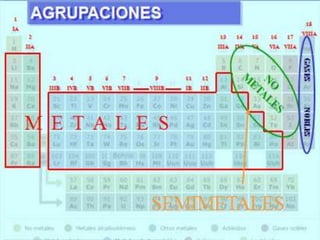
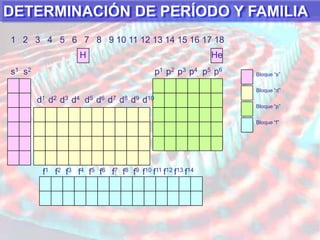
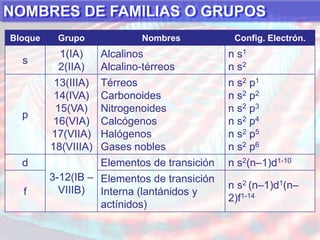
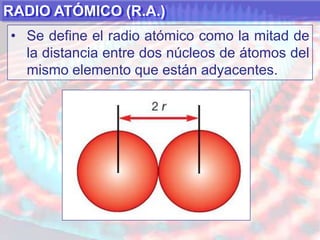
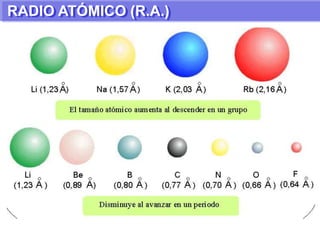
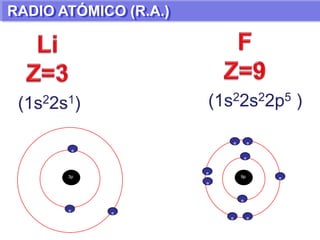
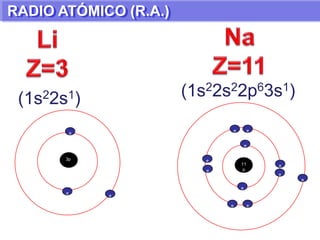
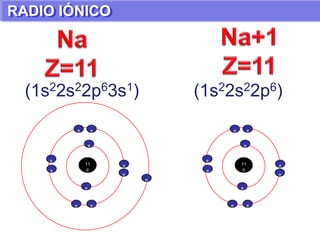
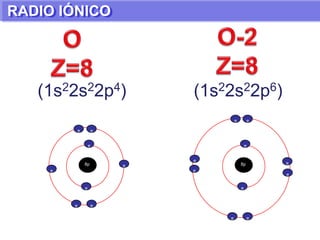
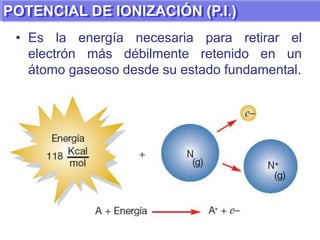
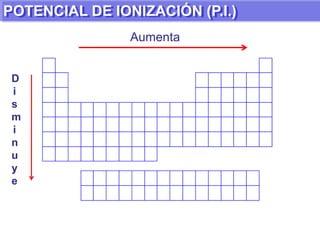
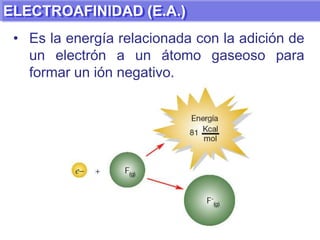
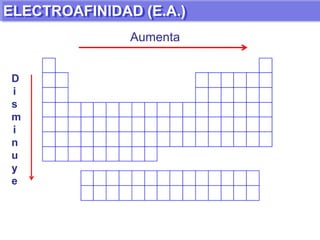
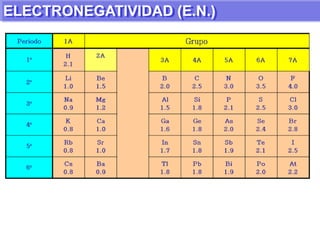
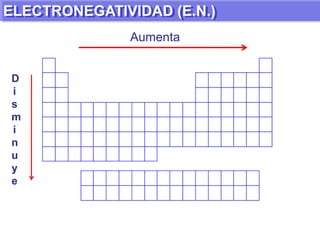
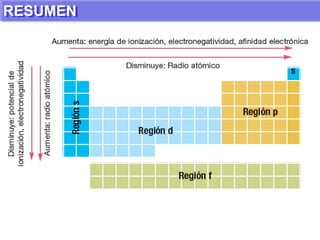
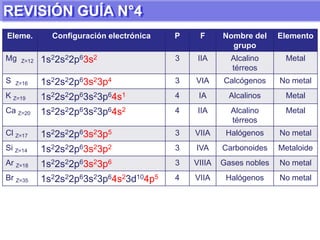
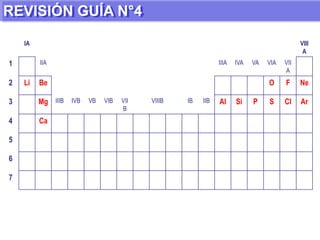
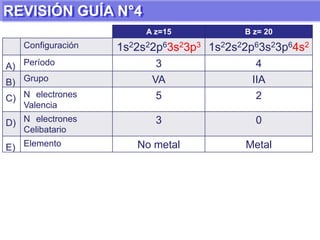
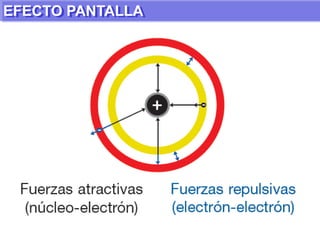
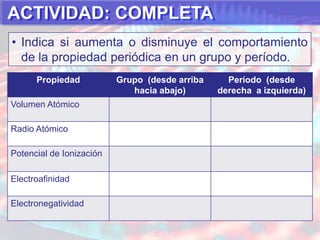
El documento presenta información sobre la tabla periódica de los elementos. Explica que la tabla periódica ordena los elementos de acuerdo a su número atómico y describe las propiedades periódicas de los elementos como el radio atómico y volumen atómico. También define conceptos clave como período, familia, elementos representativos y de transición.