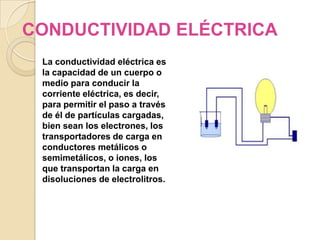
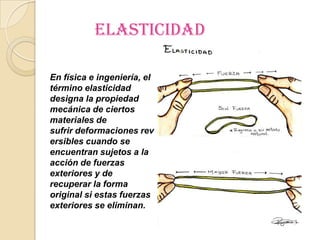
Este documento resume las propiedades fundamentales de la materia y sus diferentes estados de agregación (sólido, líquido y gaseoso), incluyendo propiedades como densidad, punto de fusión, punto de ebullición, conductividad, elasticidad, dureza y resistencia. También introduce otros estados como el estado plasmático, superfluido y la antimateria, describiendo sus características básicas.