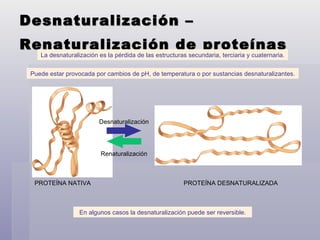
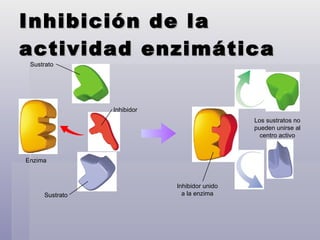
El documento habla sobre las proteínas y enzimas. Explica la estructura de los aminoácidos, la formación del enlace peptídico, y las estructuras primaria, secundaria y terciaria de las proteínas. También describe las diferentes clases de proteínas como proteínas simples, conjugadas y globulares, y sus funciones biológicas como transporte y catalizadoras. Finalmente, explica cómo actúan las enzimas acelerando las reacciones químicas a través de mecanismos como la especificidad enzim