Incrustar presentación
Descargado 186 veces







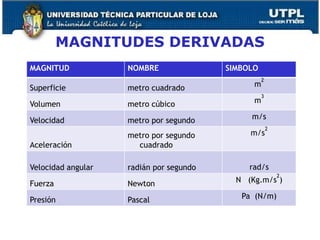

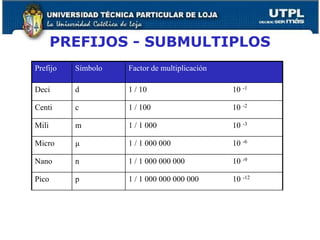




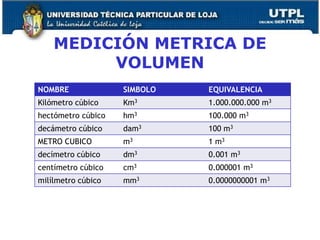




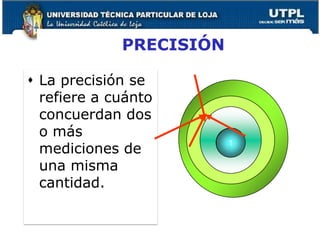








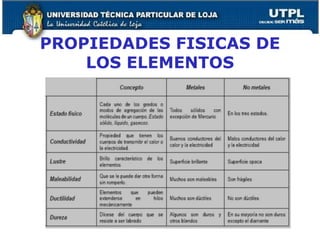






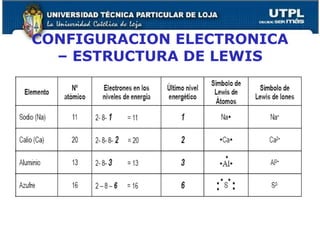

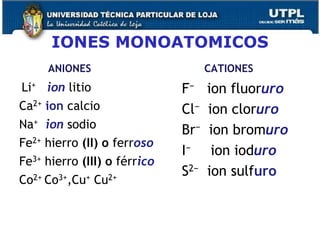
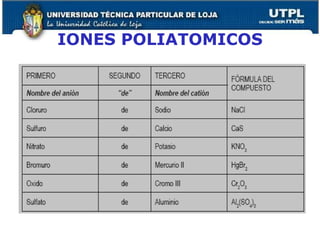
















El documento proporciona una visión general sobre mediciones fundamentales y el sistema internacional de unidades, incluyendo magnitudes fundamentales y derivadas. Se abordan conversiones entre diferentes unidades de medida, así como conceptos de precisión y exactitud en la medición. También se discuten aspectos sobre la estructura atómica, tablas periódicas y tipos de enlaces químicos.





















































