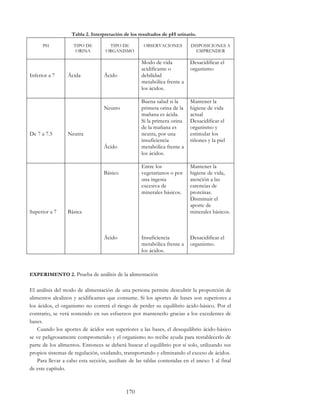
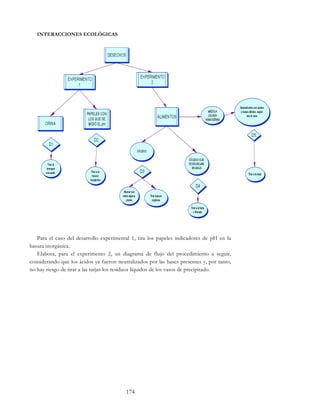
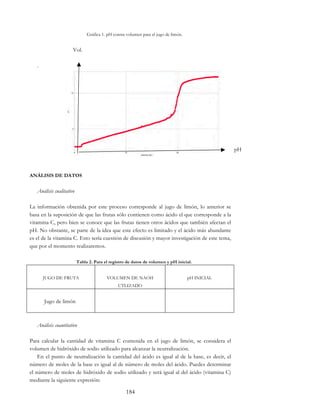
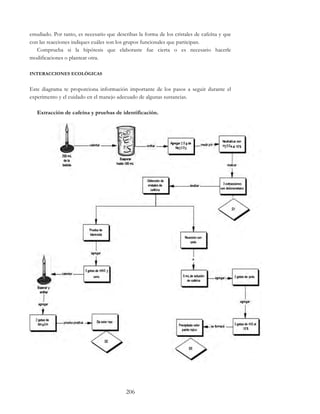
Este documento presenta un paquete didáctico de estrategias experimentales para las clases de Química I y Química II del Colegio de Ciencias y Humanidades de la UNAM. El paquete incluye una serie de actividades experimentales organizadas por temas clave de los programas de estudio, con el objetivo de que los estudiantes apliquen de manera práctica los conceptos teóricos vistos en clase. El paquete fue elaborado por un equipo de profesores del Colegio siguiendo un enfoque de aprend

























![26
a) ¿Cuál es la variable independiente que registrarás en tu gráfica? ¿En qué eje la debes
registrar?
b) ¿Cuál es la variable dependiente? ¿En qué eje se coloca?
ANÁLISIS DE RESULTADOS
A partir de los resultados obtenidos, tanto del equipo como del grupo, y de la
interpretación de la gráfica, contesta lo siguiente:
De acuerdo con los datos que se registran en la gráfica, ¿qué ocurre con la solubilidad
del gas al aumentar la temperatura?
1. La gráfica obtenida corresponde a una proporcionalidad inversa, explica ampliamente
que significa esto, considerando los datos de tu experimento.
2. ¿El pH del refresco se modifica con la presencia de CO2? Explica por qué.
3. ¿Difiere considerablemente la cantidad de gas contenido en diversas marcas de
refresco? ¿Por qué?
4. Escribe tus conclusiones.
EXPLICACIÓN CIENTÍFICA DEL FENÓMENO
La solubilidad de los gases en un líquido depende de la temperatura, la presión y la
naturaleza de las sustancias. En general, la solubilidad de los gases aumenta al disminuir la
temperatura, por ejemplo, a 0°C se disuelven cerca de 16 mg de oxígeno en 100 g de agua; y
si la temperatura de ésta se incrementa a 24°C se disuelven menos de 9 mg de oxígeno.
Este hecho explica la contaminación térmica de los lagos y ríos, pues al aumentar la
temperatura disminuye la disponibilidad de oxígeno para los organismos que ahí habitan.
Ocurre el proceso contrario con los sólidos, al aumentar la temperatura la solubilidad
aumenta. Siguiendo con el ejemplo anterior, a 0°C se disuelven 35 gramos de cloruro de
potasio y a 24°C se disuelven casi 28 gramos de esta sustancia en agua. Lo anterior
evidencia que la solubilidad de los gases aumenta al disminuir la temperatura.
Por ello, en el experimento realizado observamos que al calentar el refresco (aumentar
la temperatura) el CO2 escapa de la disolución. Este fenómeno también lo observas
cuando destapas un refresco que se encuentra a temperatura ambiente, porque se produce
un burbujeo mucho más violento que cuando el refresco está muy frío. Cuanto más fría
esté la botella más lentamente será el desprendimiento del gas y menor la intensidad del
burbujeo.
La solubilidad de los gases también depende de la presión de gas. La solubilidad de un
gas es directamente proporcional a la presión del gas sobre el líquido. Esto significa que si
la presión del gas sobre el líquido aumenta el doble, la cantidad del gas que se disuelve
también se duplica (Ley de Henry). La disolución de un gas implica confinar sus moléculas
en un volumen bastante más reducido que en el gas libre. Al aumentar la presión aumenta
la proximidad entre las moléculas gaseosas, lo que incrementa la solubilidad del gas. Para
que se produzca la carbonatación [adición de dióxido de carbono (CO2)], las bebidas
refrescantes se enfrían en grandes sistemas de refrigeración basados en amoniaco y son
embotelladas bajo una presión de dióxido de carbono superior a 1 atm.](https://image.slidesharecdn.com/quimicaiyii-180214143636/85/Quimica-iyii-26-320.jpg)




















































































![112
ANEXO 1
INFORMACIÓN PARA EL ALUMNO
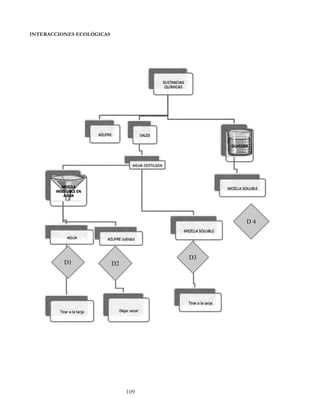
La conductividad eléctrica se define como la capacidad que tienen las sales inorgánicas en
solución (electrolitos) para conducir la corriente eléctrica.
El agua pura prácticamente no conduce la corriente. Sin embargo, el agua con sales
disueltas conduce la corriente eléctrica. Los iones cargados positiva y negativamente son
los que conducen la corriente y la cantidad conducida dependerá del número de iones
presentes y de su movilidad.
Algunas sustancias se ionizan en forma más completa que otras y por esta razón
conducen mejor la corriente. Son buenos conductores los ácidos, bases y sales inorgánicas.
Son malos conductores las moléculas de sustancias orgánicas que por la naturaleza de
sus enlaces son no iónicas: la sacarosa, el benceno, los hidrocarburos, carbohidratos, éstas
no se ionizan en el agua y entonces no conducen la corriente eléctrica.
Un aumento en la temperatura disminuye la viscosidad del agua y permite que los iones
se muevan más rápidamente, conduciendo más electricidad. Este efecto de la temperatura
es diferente para cada ion, pero típicamente para soluciones acuosas diluidas la
conductividad varía de 1 a 4 por ciento en cada grado centígrado.
Conociendo estos factores, la medición de la conductividad nos permite tener una idea
muy aproximada de la cantidad de sales disueltas.
Analicemos los compuestos no conductores en estado sólido y probemos su
conductividad disueltos en agua destilada. Entre ellos, los que se disuelven en agua son el
cloruro de sodio, el fenol y la glucosa. En la tabla 1 se resumen las propiedades de
conductividad de las disoluciones acuosas de estos compuestos. Y si probamos ahora la
conductividad de los compuestos cuando están fundidos, los resultados se muestran en la
tabla 2.
Tabla 1. Conductividad de sólidos disueltos en agua.
COMPUESTOS CONDUCTORES AL ESTAR
DISUELTOS
EN AGUA
COMPUESTOS NO CONDUCTORES AL
ESTAR DISUELTOS EN AGUA
· cloruro de sodio (NaCl) · fenol (C6H5OH)
· glucosa (C6H12O6)
Tabla 2. Conductividad de sólidos fundidos.
SÓLIDOS FUNDIDOS CONDUCTORES SÓLIDOS FUNDIDOS NO CONDUCTORES
· cloruro de sodio (NaCl)
· hidroxiapatita, [Ca5(PO4)3OH]
· diamante [C(diamante)]
· azufre (S8)
· fenol (C6H5OH)
· glucosa (C6H12O6)
Cuando se funde un material lo que ocurre es que se rompen parcialmente las
interacciones que mantienen a las entidades unidas con sus vecinas. Algo similar sucede
cuando se disuelve en agua. ¿A qué se debe que algunas sustancias en estado sólido no
conduzcan la electricidad y sí lo hagan cuando están disueltas o cuando están fundidas?](https://image.slidesharecdn.com/quimicaiyii-180214143636/85/Quimica-iyii-112-320.jpg)















![128
INFORMACIÓN PARA EL PROFESOR
ANEXO 2
Conductividad eléctrica del agua de riego
Para comprender lo que es la conductividad eléctrica (CE) del agua de riego es necesario
relacionarla con el concepto TDS, cuyo significado tiene que ver con la cantidad de
sólidos totales disueltos en el agua, principalmente sales minerales. Es medido en ppm
(partes por millón) o en mg/L. Desde que es difícil medir el TDS en el campo, se utiliza la
conductividad eléctrica del agua como una medida del TDS.
La conductividad eléctrica del agua puede ser determinada de una manera sencilla a
través de diversos aparatos de medición, en este caso utilizaremos el sensor de
conductividad eléctrica. Esta propiedad refleja la capacidad del agua para conducir
corriente eléctrica, y está directamente relacionada con la concentración de sales disueltas
en el agua.
Las sales solubles que se encuentran en los suelos en cantidades superiores al 0.1 por
ciento están formadas principalmente por los cationes Na+, Ca2+ y Mg2+ asociados con los
aniones Cl-, SO42-, NO3- y HCO3-..
Algunos de los compuestos químicos de la tabla (sales minerales) son los que
posiblemente se localicen en el suelo, esto depende del tipo de muestra que se trate.
Importancia de la medición del pH del suelo
El pH sirve para controlar muchas de las actividades químicas y biológicas que ocurren en
el suelo y tiene una influencia indirecta en el desarrollo de las plantas. Según el pH del
suelo, la disponibilidad de ciertos elementos nutritivos puede favorecerse, por ejemplo, en
los suelos de pH ácido se tratará de subir el pH por la adición de cal u otra enmienda
alcalinizante para mejorar disponibilidad de los elementos nutritivos que se fijan a un pH
ácido, como ocurre con el fósforo. El pH del suelo representa aspectos del clima,
vegetación e hidrología del lugar donde el suelo se ha formado. El pH de un horizonte del
suelo es afectado por el material parental, la naturaleza química de la lluvia, las prácticas de
manejo del suelo y las actividades de los organismos (plantas, animales y
microorganismos) que habitan en el suelo.
¿Qué es el pH?
La concentración de iones hidrógeno es una propiedad importante cuando se estudia un
suelo o algunos otros sistemas. La escala de pH se utiliza como un indicador de la
concentración de iones hidrógeno en el suelo. El pH se mide en una escala logarítmica y
representa el logaritmo negativo de la concentración de los iones hidrógeno en la solución
expresado en moles/L (pH = - log [H+]). Por ejemplo, un pH de 2 representa una
concentración de 1 x 10-2 moles/L de iones H+, y un pH 8 representa una concentración
de 1 x 10-8 moles /L de iones H+.
Cuando el suelo presenta una alta concentración de iones hidrógeno, se considera ácido
y cuando presenta una baja concentración se considera básico. Un pH 7 se considera neutro.](https://image.slidesharecdn.com/quimicaiyii-180214143636/85/Quimica-iyii-128-320.jpg)





































![166
antiácidos que contienen aluminio tienden a estreñir, muchos pacientes prefieren dosis
alternativa de los dos tipos.
Como antiácido, la leche de magnesia es administrado en dosis de aproximadamente
0.5-1.5g en adultos donde el hidróxido [Mg (OH) 2] se neutralizan con el ácido clorhídrico
estomacal.](https://image.slidesharecdn.com/quimicaiyii-180214143636/85/Quimica-iyii-166-320.jpg)