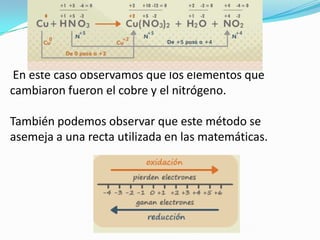
Este documento explica cómo balancear ecuaciones de óxido-reducción mediante el método de números de oxidación. Describe las reglas para asignar números de oxidación a los elementos y los pasos para balancear una ecuación, que incluyen asignar números de oxidación, identificar los elementos que cambiaron y ajustar los coeficientes para que los electrones se conserven. También brinda información sobre las propiedades de los elementos en la tabla periódica y define la oxidación y reducción en términos de pérdida y ganancia de electrones.