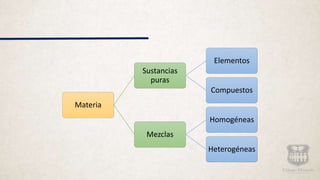
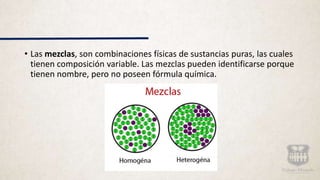
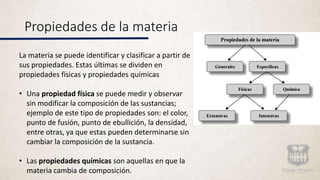
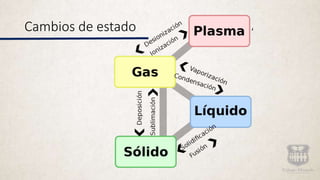
Este documento describe los diferentes tipos de materia y sus propiedades. Explica que la materia puede presentarse como sustancias puras, mezclas o elementos y compuestos. También describe las propiedades físicas y químicas de la materia, así como los diferentes estados de agregación como sólido, líquido y gas. Finalmente, introduce los conceptos de cambios de estado al modificarse las condiciones de la materia.