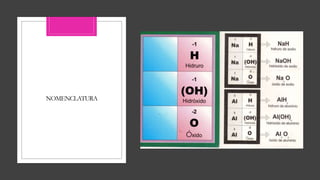
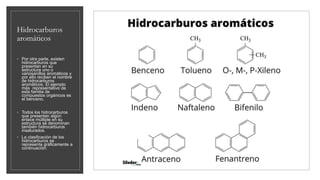
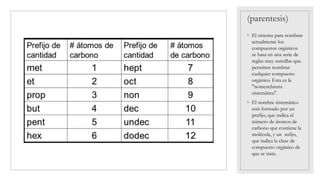
El documento trata sobre los compuestos inorgánicos, clasificándolos en óxidos, hidróxidos, ácidos, sales e hidruros. Explica que los óxidos pueden ser básicos u ácidos dependiendo del elemento con el que se combina el oxígeno, y describe las propiedades y usos de cada uno. También describe las propiedades generales de los hidróxidos, ácidos, sales e hidruros inorgánicos. El documento provee una introducción completa a estos importantes compuestos químicos in