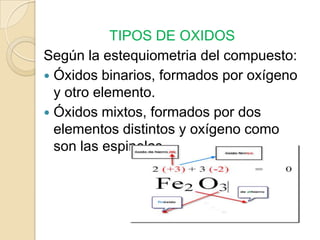
Este documento presenta una unidad sobre compuestos inorgánicos y orgánicos. Describe las clasificaciones y propiedades de óxidos, hidróxidos, ácidos, sales e hidruros inorgánicos. También cubre compuestos inorgánicos importantes económica, industrial, ambiental y socialmente en una región o país, como el oro, aluminio, mercurio, bromo, azufre y cadmio.