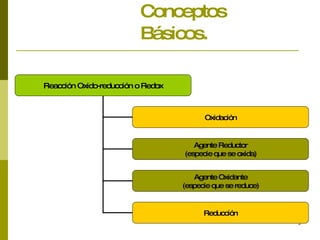
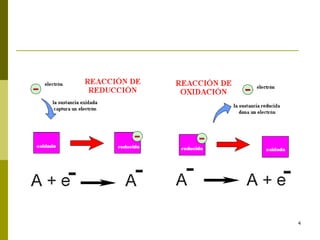
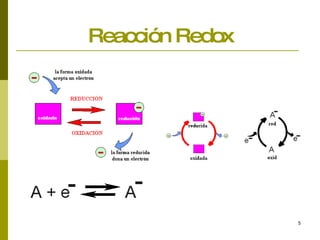
Este documento presenta conceptos básicos sobre las reacciones redox, incluyendo la oxidación, reducción, números de oxidación y principios de electronegatividad. También describe cómo las reacciones redox son importantes en procesos industriales, biológicos como la fotosíntesis y el metabolismo, y tienen consecuencias como la corrosión de metales y el funcionamiento de pilas electroquímicas.