Incrustar presentación
Descargado 10 veces



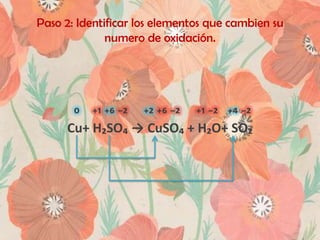
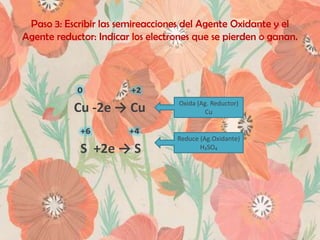




El documento describe los 7 pasos para balancear una ecuación química utilizando el método REDOX. Estos incluyen 1) asignar números de oxidación, 2) identificar los elementos que cambian su número de oxidación, 3) escribir las semireacciones del agente oxidante y reductor, 4) multiplicar las semireacciones para igualar los electrones, 5) sumar las semireacciones, 6) usar los coeficientes de las semireacciones en la ecuación original, y 7) balancear cualquier elemento restante por tanteo. El documento aplica estos








