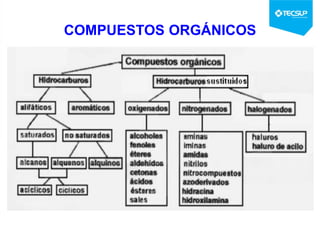
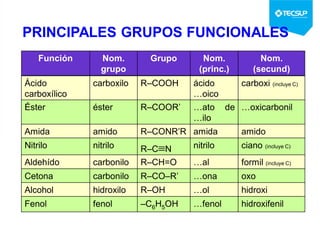
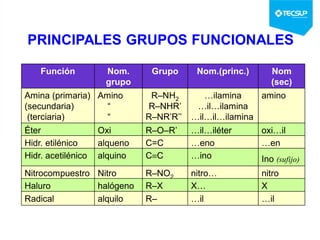
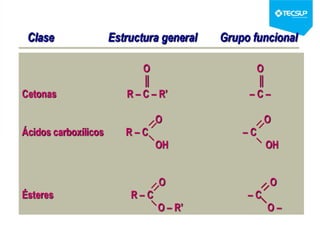
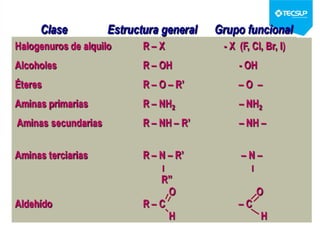
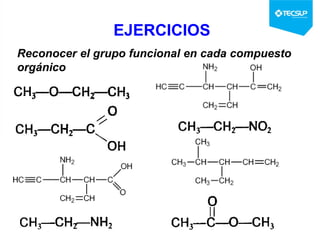
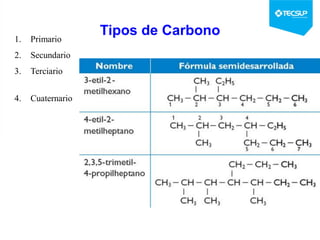
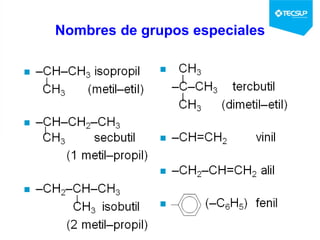
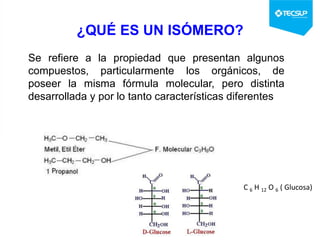
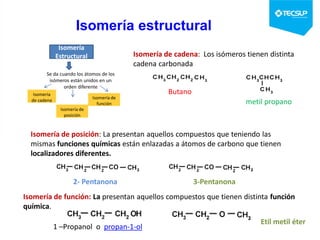
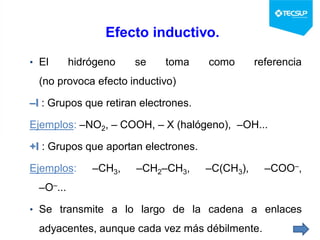
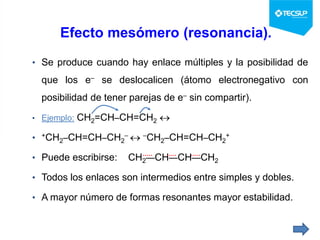
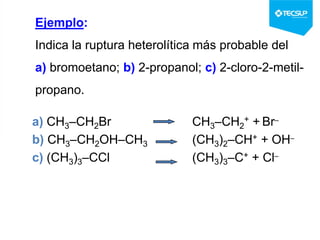
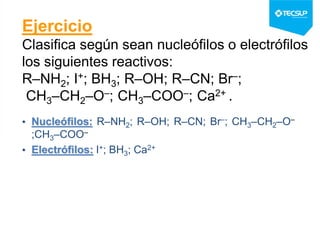
Este documento presenta una sesión de química orgánica sobre grupos funcionales e isómeros. Explica los principales grupos funcionales y sus nombres, tipos de isomería como isomería de cadena e isomería geométrica, y conceptos como efectos inductivos y mesómeros. También cubre temas como reactividad química, tipos de reacciones como sustitución y adición, y ruptura de enlaces. El objetivo es identificar los tipos de fórmulas de hidrocarburos.