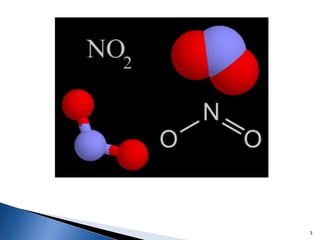
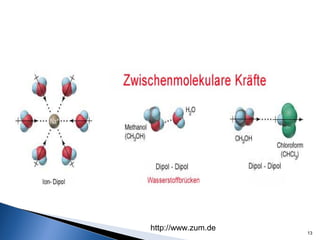
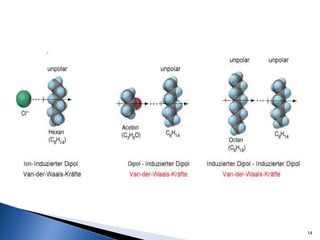
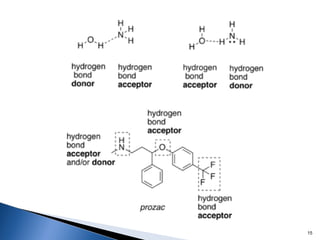
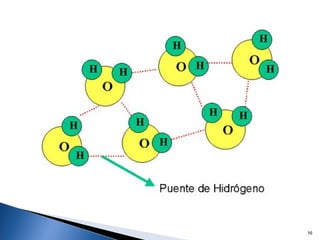
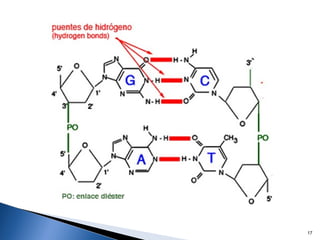
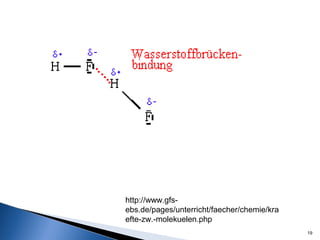
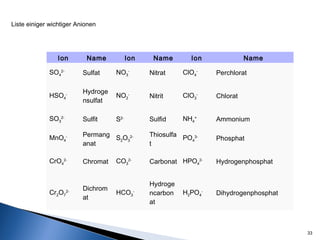
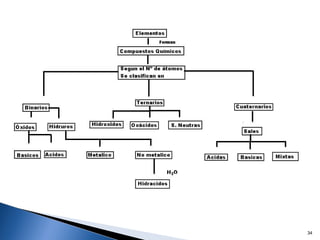
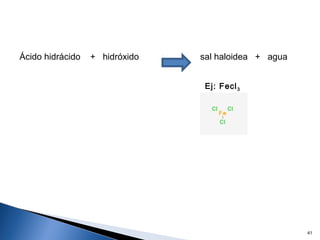
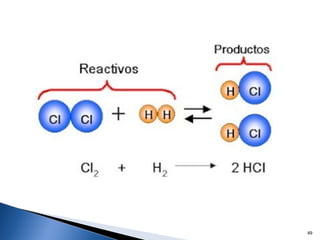
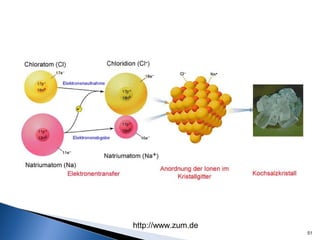
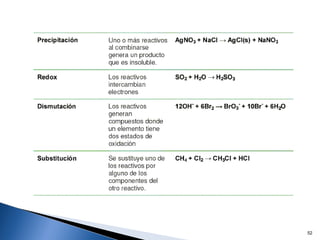
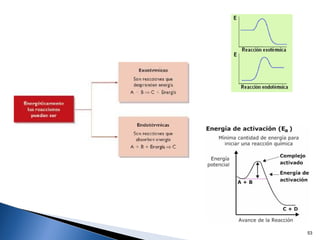
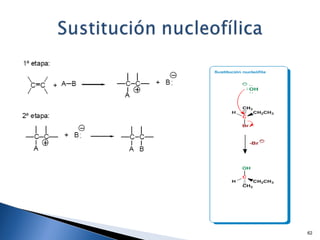
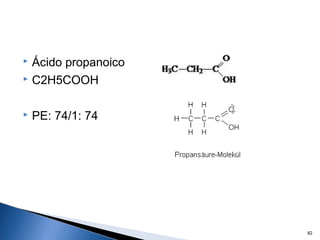
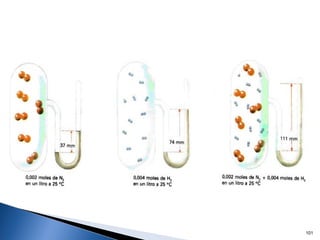
Este documento trata sobre las interacciones intermoleculares que explican las propiedades físicas de las sustancias covalentes. Se clasifican en fuerzas de van der Waals como las fuerzas de London y los enlaces de hidrógeno. Las fuerzas de van der Waals son interacciones débiles presentes en gases, líquidos y sólidos y su intensidad depende de factores como la masa molecular y el número de electrones.