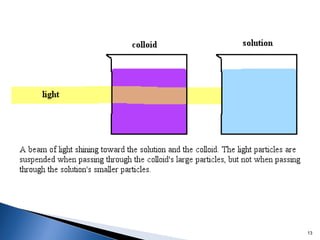
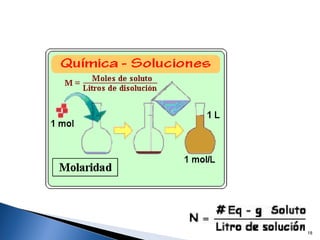
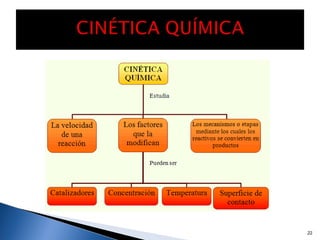
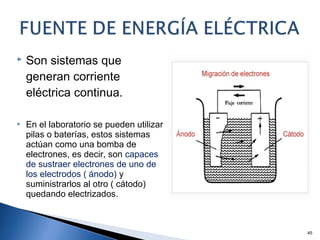
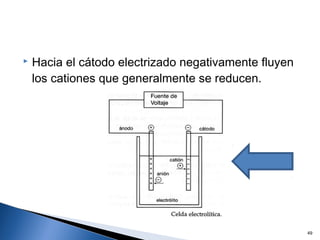
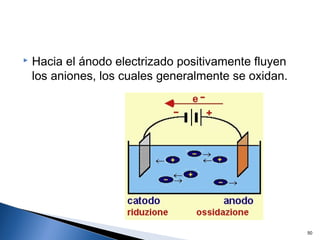
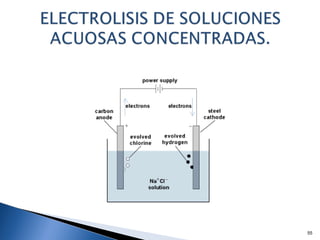
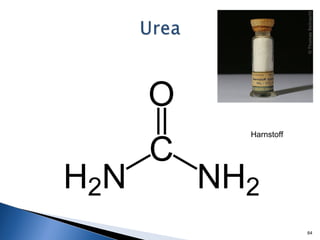
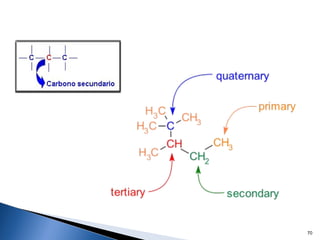
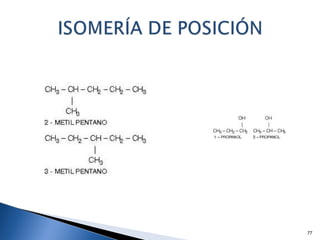
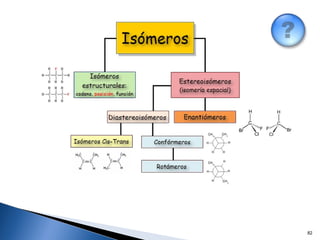
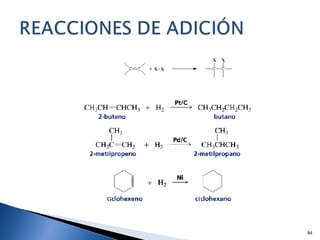
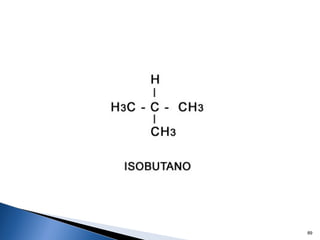
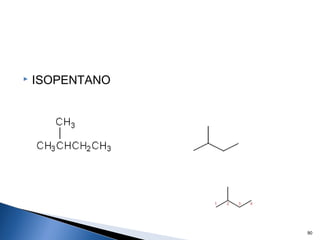
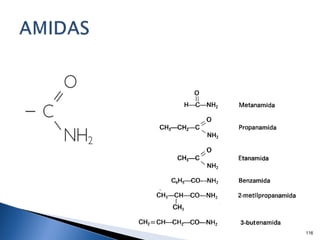
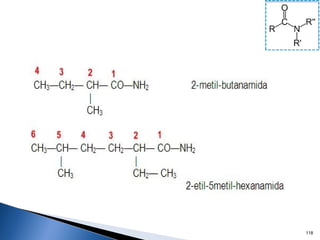
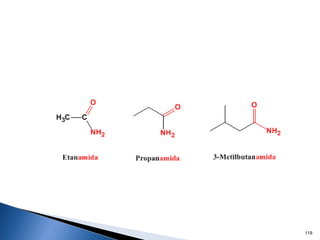
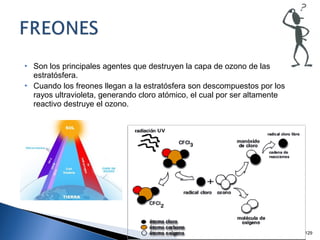
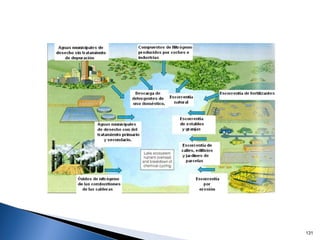
Este documento trata sobre los conceptos básicos de las coloides. Explica que son sistemas heterogéneos con una fase dispersa y otra dispersante. Describe las características de los coloides como su tamaño de partícula y su comportamiento al reposar. También define otros tipos de dispersión como las emulsiones, espumas y geles.