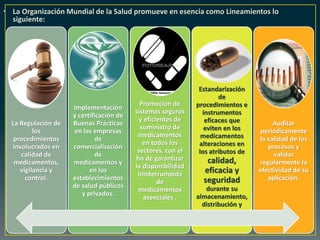
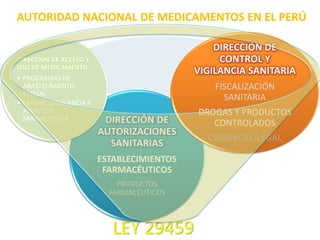
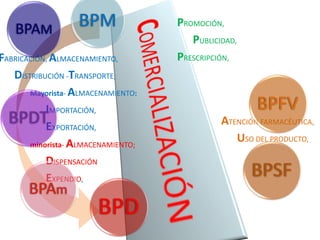
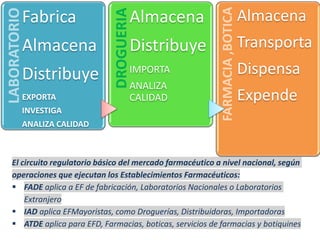
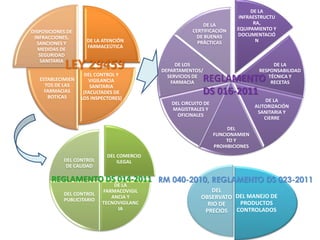
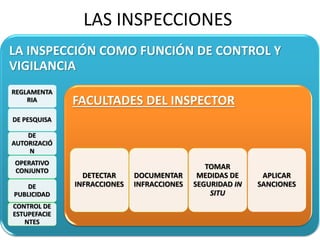
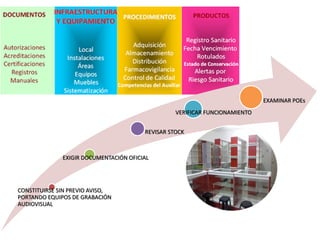
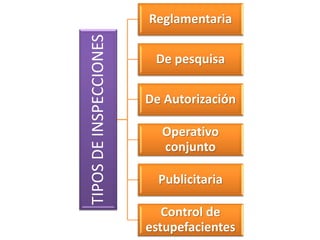
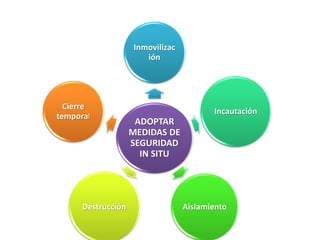
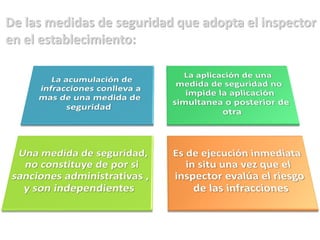
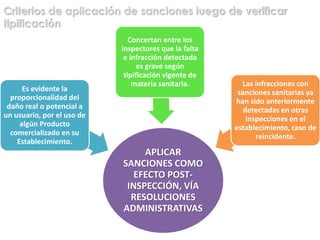
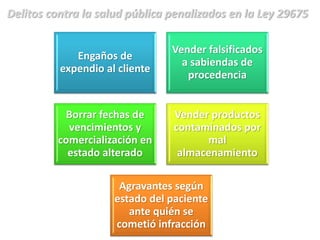
El documento analiza la nueva norma que regula los establecimientos farmacéuticos, enfatizando la importancia del cumplimiento de obligaciones por parte de farmacéuticos y administradores para evitar sanciones. Se detalla una cadena de valor que incluye aspectos logísticos y sanitarios, así como la regulación y certificación de buenas prácticas en la comercialización y distribución de medicamentos. Además, se describen las funciones de control y vigilancia sanitaria, incluyendo inspecciones y sanciones por infracciones relacionadas con la calidad y seguridad de los productos farmacéuticos.