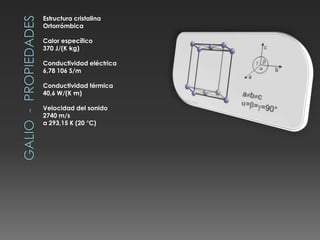
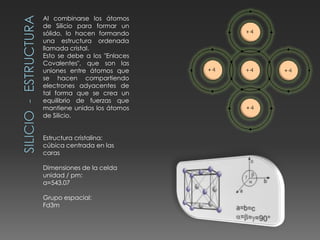
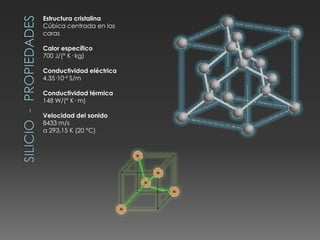
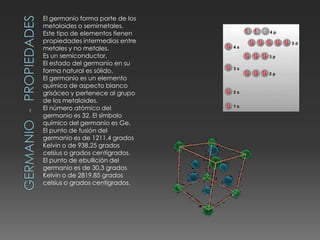
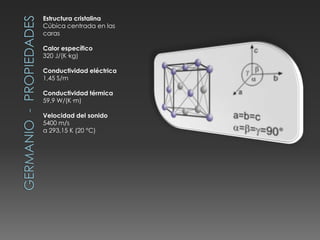
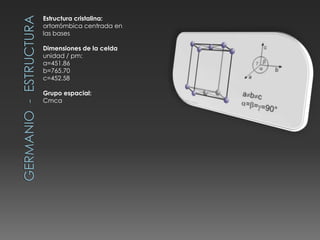
El documento describe las propiedades del silicio, germanio y galio. El silicio forma una estructura cristalina cúbica centrada en las caras debido a los enlaces covalentes entre sus átomos. Es un semiconductor con punto de fusión muy alto y conducción eléctrica pobre. Se usa en chips, celdas solares y telecomunicaciones. El germanio también es un semiconductor que forma una estructura cúbica centrada en las caras y se utiliza en circuitos integrados, lámparas y paneles solares. El galio tiene una e


![PARTICULAS: átomos unidos
en redes de enlaces
covalentes. Estructuras
abiertas, no compactas.
FUERZAS: enlaces
covalentes [más fuertes que
las fuerzas intermoleculares].
PUNTO DE FUSIÓN: muy alto.
CONDUCCIÓN: pobre
[electrones localizados en
los enlaces covalentes].
OTRAS PROP.: muy duros
[abrasivos, material de
corte y molienda].](https://image.slidesharecdn.com/slidoscristalinos-130901143647-phpapp01/85/Solidos-cristalinos-4-320.jpg)





![La configuración electrónica
del galio es [Ar]3d10 4s2 4p1.
La configuración electrónica
de los elementos, determina la
forma el la cual los electrones
están estructurados en los
átomos de un elemento.
El radio medio del galio es de
1,0 pm, su radio atómico o
radio de Bohr es de 1,6 pm, su
radio covalente es de 1,6 pm
y su radio de Van der Waals es
de 1,7 pm.
El galio tiene un total de 31
electrones cuya distribución es
la siguiente: En la primera
capa tiene 2 electrones, en la
segunda tiene 8 electrones, en
su tercera capa tiene 18
electrones y en la cuarta, 3
electrones.](https://image.slidesharecdn.com/slidoscristalinos-130901143647-phpapp01/85/Solidos-cristalinos-14-320.jpg)