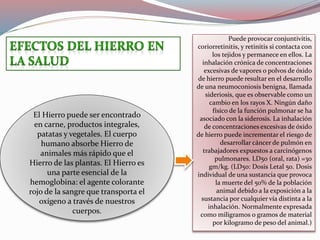
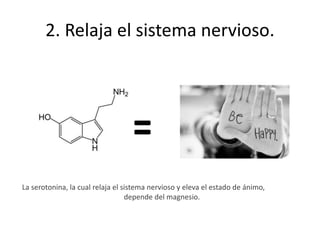
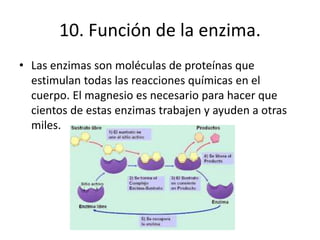
Este documento describe los elementos químicos esenciales para la vida, incluyendo el oxígeno, carbono, hidrógeno, nitrógeno, fósforo y azufre. Explica las funciones de estos seis elementos bioquímicos primarios y cómo forman parte integral de procesos metabólicos y la estructura celular. Además, clasifica otros elementos como secundarios y oligoelementos en base a su abundancia, e identifica algunas funciones clave de estos elementos traza esenciales.