Incrustar presentación
Descargar para leer sin conexión


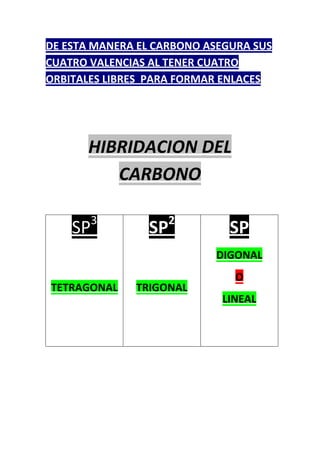





La teoría de la hibridación del carbono explica cómo el carbono puede formar 4 enlaces valenciales al mezclar sus orbitales atómicos. Según la teoría, durante la formación de enlaces los electrones del carbono alcanzan un estado excitado en el que un electrón salta de un orbital 2s a un orbital 2pz, permitiendo que el carbono tenga 4 electrones desapareados en 4 orbitales. Esto da como resultado diferentes tipos de hibridación dependiendo de la cantidad de orbitales 2p que se mezclan con el 2s, d






