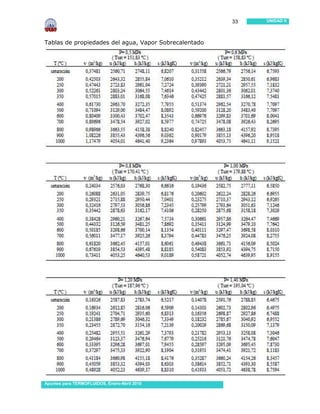
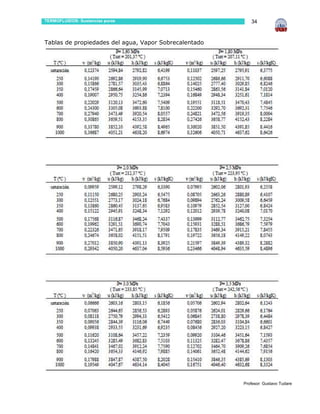
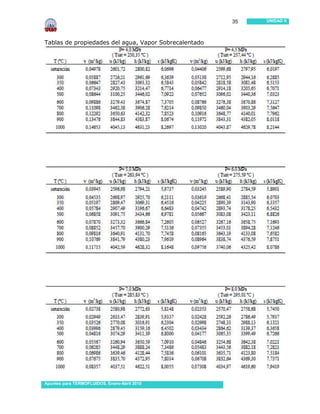
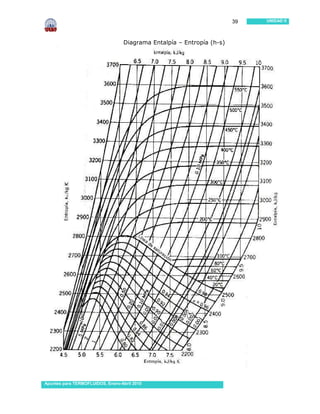
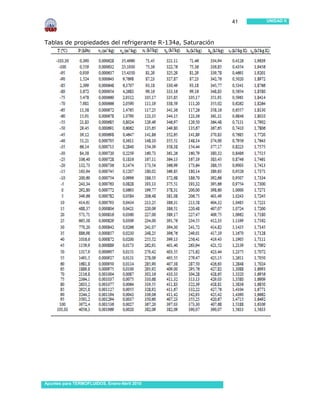
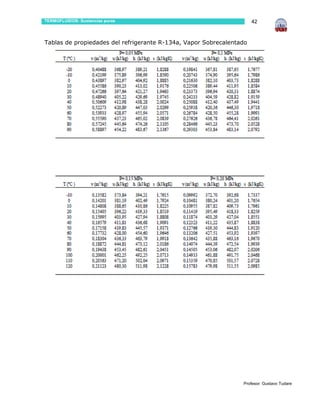
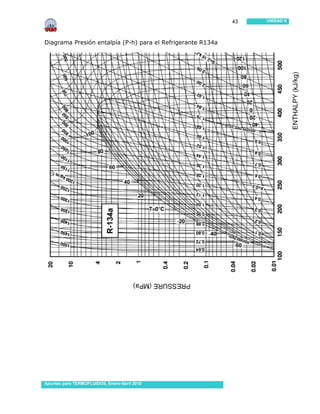
Este documento presenta información sobre sustancias puras y procesos de cambio de fase. Introduce conceptos clave como sustancias puras, fases, diagramas de propiedades, ecuación de estado de gas ideal y tablas de propiedades. Incluye ejemplos y problemas resueltos para ilustrar diferentes conceptos y el uso de tablas de propiedades. También contiene referencias bibliográficas y sugerencias de actividades.