VI-GASES IDEALES Y REALES, de la Universidad Nacional de Ingeniria
- 1. Química I: gases ideales y reales Bilma Osorio- Carlos Chafloque
- 2. GASES Medición de la presión del gas ➢La presión es una fuerza dividida por el área sobre la que se ejerce la presión ➢Como no es fácil medir la fuerza que ejerce un gas, generalmente se determina su presión en forma indirecta, comparándola con la de un liquido.
- 3. EL CONCEPTO DE PRESIÓN LIQUIDA h A
- 4. h Presión del aire (Pa) Fa Fuerza del aire Fa Fg ➢Para medir la presión que ejerce la atmósfera se utiliza el barómetro. 1 atm es la presión de un gas equivalente a la que ejerce una columna de Hg de 760 mm de altura a nivel del mar y a 0°C. Pa=h = 760 mmHg= 1 atm = 760 torr. = 1,013x106 dina/cm2 = 76cmHg
- 5. Barómetros Son aparatos que miden la presión atmosférica Los más utilizados son los barómetros metálicos que constan de una caja metálica en cuyo interior se ha hecho el vacío. Barómetro metálico Barómetro de mercurio Los barómetros de mercurio o de Torricelli, constan de un tubo de vidrio lleno de mercurio sobre una cubeta con el mismo líquido
- 6. ❖ El manómetro es un instrumento que se emplea para la medición de la presión en los fluidos y que generalmente procede determinando la diferencia que hay entre la presión del fluido y la presión local. ❖ Es un instrumento que se usa en el laboratorio para medir presiones de gases. ❖ Un instrumento neumático es aquel que trabaja con la presión de los gases. ❖ Existen manómetros abiertos y cerrados MANÓMETRO
- 7. Manómetro metálico Gas Manómetro Los manómetros metálicos aprovechan la elasticidad de los metales y constan de un tubo metálico en espiral que puede conectarse con el recipiente que contiene el gas, deformando el tubo cuando el gas penetra en él é indicándola en una escala graduada.
- 8. Manómetro
- 9. Manómetro Abierto Pgas = Pa + ρ gh Pgas = Pabsoluta Pa = Presión barométrica Pmanométrica= ρ g h PABS= PBAROMETRICA + P MANOMETRICA GAS h Pa
- 10. Manómetro Cerrado GAS Vacío h • Pgas = ρ gh P gas = Pmanométrica
- 11. Manómetro Manómetro de líquido Gas Presión atmosférica h Manómetro de líquido cerrado o de aire comprimido Gas
- 12. LEYES DE LOS GASES IDEALES 1.Ley de Boyle P V PV P K PV = K a (T y n constantes)
- 13. 2. Ley de Charles a (P y n constantes) a (V y n const.) V P T (º C) T (º K) - 273,15º 0º
- 14. Ley del Gas Ideal (gas perfecto) Para una gas a n constante, la gráfica PVT genera una superficie •Isobara: presión constante- recta, V a T •Isoterma: temperatura constante, hipérbola, PV = constante •Isocora: volumen constante - recta p a T
- 15. LEY GENERAL DE LOS GASES PV = n RT R= 0,082 atml/°Kmol I. Ley de Amagat VT = VN2 + VO2 Si PN2 = PO2 = PT N2 , O2 II. Ley de Dalton PT = PN2 + PO2 Si VN2 = VO2 = VT
- 16. Ley de Dalton de las presiones parciales V y T son constantes p1 p2 ptotal = p1 + p2
- 17. Considera el caso en el que dos gases, A y B, están en un recipiente de volumen V a T constante. pA = nART V pB = nBRT V nA es el número de moles de A nB es el número de moles de B pT = pA + pB XA = nA nA + nB XB = nB nA + nB pA = XA pT pB = XB pT pi = Xi pT
- 18. ¿Qué es la distribución de Maxwell- Boltzmann? No todas las moléculas de aire que nos rodean viajan a la misma velocidad, incluso si todo el aire se encontrara a la misma temperatura. Algunas de las moléculas se estarán moviendo muy rápido, algunas muy lento y otras apenas se moverán. Debido a esto, no tienen sentido preguntas como "¿Cuál es la velocidad de una molécula de aire en un gas?", ya que, dentro de una gama enorme, podría tener cualquier velocidad.
- 20. GASES REALES ❖Son los gases que realmente existen y con los que podemos interactuar. ❖Si un gas obedece la ley de Boyle, se define como un gas ideal. ❖Los resultados de estudios hechos con diferentes gases, a lo largo de una amplia gama de presiones y temperaturas, indican que todos los gases muestran desviaciones del comportamiento ideal. ❖Estas desviaciones se clasifican en dos tipos: desviaciones aparentes y reales
- 21. Desviaciones Aparentes Esto sucede con mezclas de gases en los cuales se establece un equilibrio, si la reacción química produce un cambio en el número de moléculas del sistema. Si PV = nT RT ….(1) N2O4 (g) 2 NO2 (g) Inicial : no 0 Equilibrio : no – noα 2 no α a=grado de disociación nT = no (α + 1) Reemplazando en (1) PV= no (1 + α) RT
- 23. Desviaciones Reales 1 mol de gas ideal PV = nRT n = PV RT = 1.0 Z =
- 24. Desviación del comportamiento ideal de los gases reales. Fuerzas de repulsion Fuerzas de atracción Gráfica para 1 mol de varios gases en función de la presión. Los gases reales se desvían del comportamiento ideal a presiones altas.
- 25. ✓vemos que las moléculas homoatómicas pequeñas tienden a desviarse del ideal en un grado menos que las heteroatomicas de mayor tamaño. ✓Las moléculas pequeñas como el H2 y algunos gases raros, manifiestan desviaciones positivas, mientras que las moléculas mayores presentan desviaciones negativas del ideal. ✓A menor Temperatura se presenta desviación negativa.
- 26. Desviación del comportamiento ideal de los gases reales. Z=
- 27. ❖Gráfica de 1 mol de un mismo gas en función de la presión a diferentes temperaturas. ❖Al aumentar la T, el comportamiento del gas se aproxima al ideal. ❖Las desviaciones aumenten a medida que nos aproximamos a la temperatura de licuefacción del gas.
- 28. ¿Por qué se dan estas desviaciones? ❖Según la Teoría Cinética Molecular los gases carecen de fuerzas de atracción y no poseen volumen sus partículas. ❖Pero en los gases reales las partículas tienen tamaño y existe la presencia de las fuerzas intermoleculares (fuerzas de atracción y de repulsión).
- 29. A presiones altas el volumen del gas no es despreciable. El espacio libre por el cual pueden moverse la moléculas es un poco menor al del sistema. Esto genera que el V del gas sea mayor al del espacio vació.
- 30. A presiones altas las fuerzas de atracción son apreciables. El resultado de estas interacciones es una presión menor a la presión que predice la ecuación del gas ideal.
- 31. Ecuación de Vander Waals ✓Vander Waals incorporó las fuerzas intermoleculares y los volúmenes moleculares finitos a una ecuación de estado para gases reales. ✓Las correcciones que se presentan debido al tamaño molecular: El volumen ideal en términos del volumen real corregido para el volumen molar excluido, b, para n moléculas es: Vid = V – n b …..(1)
- 32. ✓Las correcciones que se presentan debido a fuerzas intermoleculares son: Pid = P + an2 V2 …..(2) La ecuación ideal es: P id Vid = n RT ….. (3) Reemplazando (1) y (2) en (3) ( ) nRT nb V V an p = − + 2 2 Ecuación de van der Waals
- 33. ✓a y b son las constantes de Vander Waals donde: “a” depende de las fuerzas intermoleculares “b” depende del tamaño de las moléculas Para 1 mol de gas:
- 34. Constantes de van der Waals Gas a (atmL2/mol2) b (L/mol) He 0.034 0.0237 Ar 1.34 0.0322 H2 0.244 0.0266 N2 1.39 0.0391 O2 1.36 0.0318
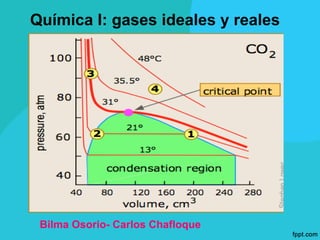
- 35. En la figura inferior se han representado las isotermas de Andrews, medidas experimentalmente, y representan la presión en función del volumen a distintas temperaturas.
- 36. Licuefacción de los gases y el estado critico
- 37. Licuefacción de los gases y el estado crítico Isotermas del Isopentano
- 38. ❖A 188.8 °C, las presiones horizontales de las isotermas se reduce hasta alcanzar un punto que se denomina punto critico. ❖A temperaturas suficientemente bajas, cualquier gas puede ser licuado aplicándole presión. ❖A lo largo de las líneas horizontales el gas y el liquido coexisten. ❖La compresión de un gas a temperaturas superiores al punto critico no produce licuefacción por grande que sea la presión que se aplica.
- 39. Curva de saturación = curva de ebullición + curva de rocío.
- 40. Para una mol de gas reordenando (a) En el punto critico: V = Vc , (V - Vc)3 = 0 Al desarrollar esta ecuación se tiene: () Comparando esta ecuación con la ecuación α
- 41. a = 27 R2 Tc2 64 Pc b = R x Tc 8 Pc Resolviendo, tenemos
- 42. Problema N°1 Se almacena gas propano en un tanque de cilindro de 800 L, a una presión de 200 atm y 400°C. Al manipular el tanque, se produce un escape del gas propano, a un medio exterior que se encuentra a 60°C y 20 atm. Después del escape del gas, en el tanque queda 1670 moles de gas propano a 70 atm de presión. Determinar: A) El factor de compresibilidad (Z), del gas en el tanque, antes y después del escape. B) La masa y Z del gas que se escapó al medio exterior. TC = 96.8°C y PC = 41.92 atm
- 43. Solución del Problema N° 1 En primer lugar calculamos las constantes de Van der Waals para el gas propano. a = 27 R2 Tc2 64 Pc b = R x Tc 8 Pc
- 47. Problema N°2 En un tanque (A) de 2.5 L, se almacena gas propano a 12.6°C y 159 atm. En otro tanque (B) de 4.5 L se almacena gas metano a 393.4°C, 363.5 atm y factor de compresibilidad (Z) de 1.15. Cuando se conectan estos tanques se difunde el gas hasta alcanzar la misma presión en ambos tanques y una temperatura de 250°C. Determinar: a) El Z en el tanque (A) antes de conectar al tanque (B) y el Z final . b) La presión y el numero de moles finales. Propano: TC = 96.8°C y PC = 41.92 atm Metano : TC = -82.6°C y PC = 45.44 atm
- 48. Problema N°3 Se almacena gas propileno (M= 42 g/mol) en tres tanques A, B y C. El tanque A con un volumen de 500 L, contiene el gas a 120°C y 200 atm. El tanque B con un volumen de 800 L contiene 4307 moles de gas a 120 atm y el tanque C contiene 2407.4 moles de gas a 200°C y 180 atm. Cuando se conectan estos tres tanques, se difunde el gas hasta una presión final y una temperatura de 162°C. Determinar: a) La masa total del gas en los tres tanques y el factor de compresibilidad (Z) en el tanque B antes de conectarlos. b) La presión final y Z después de conectar los tres tanques.
- 49. Problema N°4 Una mezcla gaseosa de metano (CH4) y acetileno (C2H2), ocupan cierto volumen a una presión total de 70.5 mmHg. La mezcla gaseosa combustiona y forma CO2 y H2O; el agua se elimina y el CO2 que resta tiene una presión de 96.4 mmHg al mismo volumen y temperatura que la mezcla original. ¿Qué fracción de gas era metano? 5. Para las siguientes sustancias: C3H8, NH3, H2O, CCl4, MgCl2, C6H5Cl y C6H5OH. a) Indicar el tipo de fuerza intermolecular predominante. b) Determinar el orden creciente de la temperatura de ebullición normal. Explique.
- 50. 6. Para las siguientes especies: N2O3 y H3PO2 a)Dibujar la estructura de Lewis. b)Por el método de RPENV indicar y dibujar la forma geométrica. (2p) c) Indicar la hibridación del átomo central.
- 51. ) Se tiene: y Determinar el que tiene mayor temperatura de ebullición. Explique.
- 52. Test de gases 1. Explique sobre: A.) Manómetro B.) Barómetro 2. ¿Que es: A.) Presión manométrica. B.) Presión absoluta. 3. ¿Cuándo se producen las desviaciones aparentes ? Explíque con un ejemplo. 3. ¿Cuando se considera un gas real? 4. Explique: A.)Factor de compresibilidad B.)Punto crítico 5. Explique sobre la ecuación de Van der Waals.
- 53. ▪ Raymond Chang, Kenneth A. Goldsby. Química general, 12va edición. Editorial: Mc Graw- Hill/Interamericana de México. 2016. ▪ R.H. Petrucci; F. G. Herring y otros, Química general: Principios y aplicaciones modernas, 11va edición. Editorial Pearson. 2017. ▪ T. L. Brow “ Química la ciencia central” PHH. 1998 ▪ John B. Rusell- química general Mc. Graw-Nill. 1994 Bibliografía