Este documento describe los principios de la volumetría de neutralización para sistemas simples y complejos. Explica cómo calcular el pH en reacciones de ácidos fuertes con bases fuertes, ácidos débiles con bases fuertes, y sales como NaAH. También cubre el efecto de la concentración, el valor de Ka, y la selección de indicadores. Finalmente, presenta ejemplos numéricos del cálculo del pH en una reacción compleja entre un ácido débil y una base fuerte.

![Compuestos orgánicos complicados de alto PM
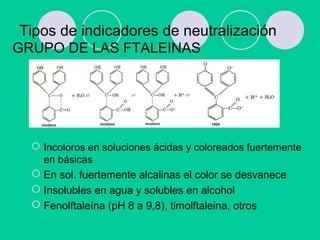
Comportamiento de ácidos y bases débiles
H2O + H In H3O+
+ In-
color ácido color básico
Ka = [H3O] [In-] [In-
] < 1
[H In] [H In ] 10
In + H2O In H+
+ OH-
color básico color ácido
Ka = [InH] [OH] [In] < 10
[In] [H In ] 1](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-2-320.jpg)
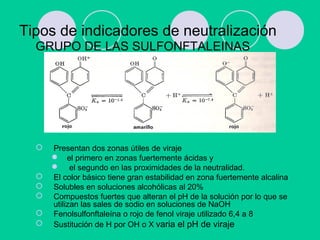
![Ka = [H3O +
] [In-] Kb = [InH] [OH]
[H In] [In]
[In-
] < 1 [In -
] < 10
[H In ] 10 [H In ] 1
color ácido color básico
Ka = [H3O +
] [In -
]= [H3O +
] 1
[H In] 10
[H3O +
] = 10 Ka pH = -log Ka- 1
[H3O +
] = 1 Ka pH = -log Ka +1
10](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-3-320.jpg)

![Acido fuerte con base fuerte (HCl con NaOH)
H3O+
+ OH-
2 H2O
Ej. 50ml de HCl 0,100N con NaOH 0,100N
1- Cálculo del pH inicial
pH= -log (0,1)= 1
2- Agregado de 10ml de base valorante
Nro. Meq de HCl que quedan= 50*0,1 – 10*0,1=4.0
NHCl = [H3O +
] = 4.0/60
pH = - log (4.0/60)= 1,18](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-8-320.jpg)
![3- Agregado de 50ml de base valorante
Nro. Meq de HCl = Nro. Meq de NaOH
pH = 7
4- Agregado de 50,01ml de base
NNaOH = [HO -
] = 50,01*0,1- 50,0*0,1= 0,0000100
100,01
pOH = 5
pH = 14,00 – 5,00 = 9,00](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-9-320.jpg)

![Acido débil con base fuerte (AcOH con NaOH)
Ej. 50ml de AcOH 0,100 N (Ka= 1,75 . 10-5
con NaOH
0,100N
1- Cálculo de pH inicial
HA H+
+ A-
Ka = [H+
][A-
] / [HA]
H2O H+
+ OH-
Kw = [H+
][OH-
]
[H+
]= [A-
] + [OH-
] [H+
]= [A-
]= x
FAH = [A-
] + [HA] [HA]= FAH -x
Ka = X2
/ (FAH –x) x = [H+
]=√ Ka FAH
pH = - log [H+
]=- log (√ Ka FAH)= 2,88](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-11-320.jpg)
![2- pH después de agregar 10ml de valorante
Se ha formado una solución buffer
FHOAc= 50 0,1 – 10*0,1= 4,0
60 60
F NaOAc = 10*0,1 = 1
60 60
x *1/60 = Ka= 1,75 . 10-5
4/60
[H+
]= x = 7.10-5
pH = 4,15](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-12-320.jpg)
![3 - pH del punto de equivalencia Todo el HAcO se
convierte en NaAcO y se trata como si la sal estuviera
disuelta en agua.
O Ac-
+ H2O HAcO + OH-
F NaOAc = 10*0,1 = 1 = 0,05
100 100
Poniendo x= [OH-]
x2
_____ = x2
= 1.10 -14
F NaOAc – x 0,05 1,75 . 10-5
x = [OH-
] = 5.36 . 10-6
pOH = 5,27
pH = 8,73](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-13-320.jpg)
![4- pH después de agregar 50,10ml de
valorante
F NaOH = 50,10* 0,1 – 50,0* 0,1= 1,0 . 10-4
100,10
[OH-
]= F NaOH = 1,0 . 10-4
pOH = 4,0
pH = 10,0](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-14-320.jpg)





![VOLUMETRIAS DE NEUTRALIZACION
DE SISTEMAS COMPLEJOS
Cálculo del pH de soluciones de sales
ácidas tipo NaAH
HA-
+H2O H2A + OH-
HA-
+H2O A 2+
+ H3O +
a) Kb = Kw/K1 = [H2A] [OH-
] / [HA-
]
b) K2 = [A 2+
][H3O +
]/[HA-
]
Si Kb > K2 solución básica
Si Kb < K2 solución ácida](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-21-320.jpg)
![VOLUMETRIAS DE NEUTRALIZACION
DE SISTEMAS COMPLEJOS
a) Kb = Kw/K1= [H2A] [OH-
] / [HA-
]
b) K2 = [A 2+
][H3O +
]/[HA-
]
c) F NaHA = [H2A] + [HA-
] + [ A 2+
]
[Na+
] + [H3O+
] == [HA-
]+ [OH-
] +2 [ A 2-
]
d) F NaHA = [HA-
]+ [OH] + 2 [ A 2-
] - [H3O+
]
e) Kw = [OH-
] [H3O+
]](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-22-320.jpg)
![ Igualando c) y d)
[HA-
] + [ H2A] + [ A 2-
] = [HA -
] + [ OH -
] +2 [ A 2-
] - [H3O +
]
Kb = Kw = [H2A] [OH-] = [A 2-
][H3O +
] = K2
K1 [HA -
] [HA -
]
Kw [HA- ] = K2 [HA -
] + [OH-] - [H3O +
] = K2 [HA -
] + Kw - [H3O +
]
K1[OH-] [H3O +
] [H3O +
] [H3O +
]
Kw [HA -
] [H3O +
] = K2 [HA -
] [H3O +
] + Kw [H3O +
] - [H3O +
] [H3O +
]
K1[OH-] [H3O +] [H3O +]
[H3O +]2
([HA -
] + 1) = K2 [HA -
] + Kw [H3O +]
K1
[H3O +] = √ K1K2 [HA -
] +K1Kw = √ K1K2 F NaHA +K1Kw
[HA -
] + K1 F NaHA + K1
[H3O +] = √ K1K2](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-23-320.jpg)
![ [H3O +] = √ K1K2 [HA -
] +K1Kw
[HA -
] + K1
Esta ecuación es útil solo si
[HA -
] ≈ F NaHA
[H3O +] = √ K1K2 F NaHA +K1Kw
F NaHA + K1
Frecuentemente K1<< F NaHA
K1Kw<< K1K2 F NaHA
[H3O +] = √ K1K2
“El pH de una solución de una sal
del tipo NaHA es independiente de la
concentración de la sal”](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-24-320.jpg)
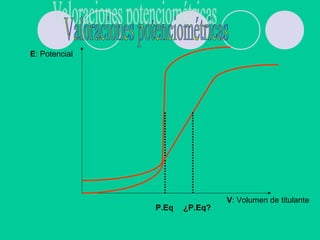
![Curvas de valoración de sistemas
complejos
Primer tipo: Acido débil tipo H2A
H2A + H2O H3O+
+ AH-
K1 =[H3O+ ][AH-]
[H2A]
H2A + H2O H3O+
+ A2-
K1 =[H3O+ ][A2-
]
[H2A]
Segundo tipo; Dos ácidos monopróticos
HA + H2O H3O+
+ A-
K1 =[H3O+ ][A-]
[HA]
HX + H2O H3O+
+ X-
K1 =[H3O+ ][X-
]
[HX]
Tercer tipo : sales tipo Na2A
H3O+
+ A2-
OH-
+ AH-
K1 =[OH-
][AH-]
[A2-
]
AH-
+ H2O H2A + OH-
K1 =[OH-
][H2A]](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-25-320.jpg)

![1- Valor inicial del pH
x ≈ [H3O+
] ≈ [MH-
]
0,100 - x ≈ [MH2]
x2
= K1 = 1,5 .10 -2
0,100 - x
x = 3,2.10 -2
pH =1,5](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-27-320.jpg)
![2 – Primera región tampón
F H2M = 25,0* 0,1 - 5,0 * 0,100 = 6,67. 10 -2
30,0
F NaHM = 5,0 * 0,100 = 1,67. 10 -2
30,0
x = [H3O+
]
[H2M] = 6,67. 10 -2
– x
[HM-
] = 1,67. 10 -2
+ x
Ka = x (1,67. 10 -2
+ x) = 1,5 . 10 -2
(6,67. 10 -2
– x)
x = [H3O+
] = 1,95. 10 -2
mol / litro
pH = 1,71](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-28-320.jpg)
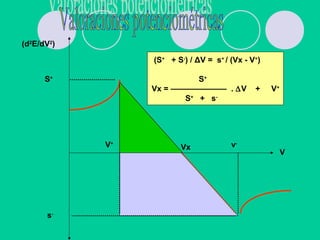
![3- Primer punto de equivalencia
Se han agregado 25 ml de base la solución
es 0,050 F para la sal ácida NaHM
[H3O +] = √ K1K2 [HM- ] +K1Kw = √ K1K2 F NaHM +K1Kw
[HM- ] + K1 F NaHM + K1
pH = 4,26](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-29-320.jpg)
![4- Segunda región tampón
Mas agregado de base genera una nueva solución tampón (ác.debil
HM-
y su sal M -2)
El pH se calcula con K2
HM-
+ H2O H2M + OH-
[H+] = K2 F[HM-] / F [M2-]
Siempre que K2<1000K1
Se agregó 25,5 ml de base
FNa2M = 25,5* 0,1 – 25* 0,1 = 0,050
50,5 50,5
FNaHM = 25,0* 0,1 – (25,5- 25,0)* 0,1 = 2,45
50,5 50,5
K2= [H+] {FNa2M + [H+] } = x{(0,050/50,5) + x} = 2,6 .10-7
FNaHM - [H+] 2,45 – x
x = 1,29 .10-5](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-30-320.jpg)
![5- Segundo punto de equivalencia
Se agregó 50ml de base la soluión es 0,0333F en Na2M
M-2
+ H2O HM-
+ OH-
HM-
+ OH-
H2M + OH-
Kh1 = Kw = [HM-
][OH-
] Kh2 = Kw = [H2M] [OH-
]
K2 [M-2
] K1 [HM-
]
FNa2M = 25,5* 0,1 – 25* 0,1 = 0,050
50,5 50,5
FNaHM = 25,0* 0,1 – (25,5 - 25,0)* 0,1 = 2,45
50,5 50,5
K2= [H+] {FNa2M + [H+] } = x{(0,050/50,5) + x} = 2,6 .10-7
FNaHM - [H+] 2,45 – x
x = 1,29 .10-5](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-31-320.jpg)




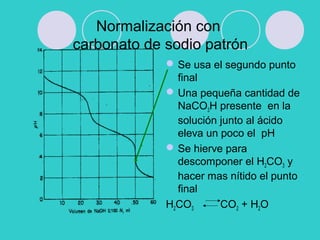
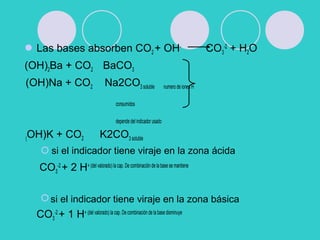
![ Valoración de carbonato de sodio con
ácido clorhídrico
H2CO3 HCO3
-
+ H3O K1= 4,6. 10-7
HCO3
-
H3O+
+ CO3
2-
K2= 4,4. 10-11
Primera adición de HCl se forma un
tampon de carbonato-bicarbonato para el
calculo de pH se usa K2 y se desprecia la
hidrólisis de bicarbonato a ácido
carbónico
En el primer Pf hay solución de
bicarbonato
Con mas agregado de HCl se forma el
buffer bicarbonato- ác. Carbónico y el pH
se calcula con la K1
En el 2° PF la solución es ác, carbónico y
NaCl la [H] se calcula como ác. Débil
Con un exceso de HCl la [H+]es la del
ác- fuerte-](https://image.slidesharecdn.com/voluneutralizacionypotenc2011-130605170034-phpapp02/85/Volu-neutralizacion-y-potenc-2011-36-320.jpg)