Compuestos Orgánicos Alifáticos
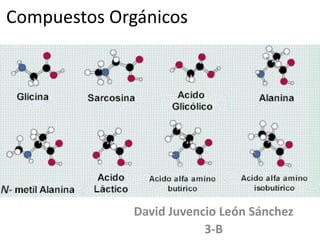
- 1. Compuestos Orgánicos David Juvencio León Sánchez 3-B
- 2. El petróleo (del griego: πετρέλαιον, "aceite de roca") es una mezcla homogénea de compuestos orgánicos, principalmente hidrocarburos insolubles en agua. También es conocido como petróleo crudo o simplemente crudo. Se produce en el interior de la Tierra, por transformación de la materia orgánica acumulada en sedimentos del pasado geológico y puede acumularse entrampas geológicas naturales, de donde se extrae mediante la perforación de pozos. El proceso de perforación de pozos petroleros y de gas natural se realiza en las etapas de exploración y desarrollo, de lo que la industria petrolera se conoce como upstream. La extracción es una actividad de la última etapa del upstream, denominada producción. Si la presión de los fluidos es suficiente, forzará la salida natural del petróleo a través del pozo que se conecta mediante una red de oleoductos hacia su tratamiento primario, donde se deshidrata y estabiliza eliminando los compuestos más volátiles. Posteriormente se transporta a refinerías o plantas de mejoramiento. Durante la vida del yacimiento, la presión descenderá y será necesario usar otras técnicas para la extracción del petróleo. Esas técnicas incluyen la extracción mediante bombas, la inyección de agua o la inyección de gas, entre otras.
- 3. • El petróleo está formado principalmente por hidrocarburos, que son compuestos de hidrógeno y carbono, en su mayoría parafinas, naftenos y aromáticos. Junto con cantidades variables de derivados saturados homólogos del metano (CH4). Su fórmula general es CnH2n+2. • Cicloalcanos o cicloparafinas-naftenos: hidrocarburos cíclicos saturados, derivados del ciclopropano (C3H6) y del ciclohexano (C6H12). Muchos de estos hidrocarburos contienen grupos metilo en contacto con cadenas parafínicas ramificadas. Su fórmula general es CnH2n. • Hidrocarburos aromáticos: hidrocarburos cíclicos insaturados constituidos por el benceno (C6H6) y sus homólogos. Su fórmula general es CnHn. • Alquenos u olefinas: moléculas lineales o ramificadas que contienen un enlace doble de carbono (-C=C-). Su fórmula general es CnH2n. Tienen terminación -"eno". • Dienos: Son moléculas lineales o ramificadas que contienen dos enlaces dobles de carbono. Su fórmula general es CnH2n-2. • Alquinos: moléculas lineales o ramificadas que contienen un enlace triple de carbono. Su fórmula general es: CnH2n-2. Tienen terminación -"ino". Además de hidrocarburos, el petróleo contiene otros compuestos que se encuentran dentro del grupo de orgánicos, entre los que destacan sulfuros orgánicos, compuestos de nitrógenoy de oxígeno. También hay trazas de compuestos metálicos, tales como sodio(Na), hierro (Fe), níquel (Ni), vanadio (V) o plomo (Pb). Asimismo, se pueden encontrar trazas de porfirinas.
- 6. Alifáticos • Los hidrocarburos alifáticos son compuestos orgánicos constituidos por carbono e hidrógeno, en los cuales los átomos de carbono forman cadenas abiertas. Los hidrocarburos alifáticos de cadena abierta se clasifican en alcanos, alcenos o alquenos y alcinos o alquinos. Los primeros son los que presentan sólo enlaces sencillos entre átomos de carbono, mientras que los alquenos y alquinos presentan enlaces doble y triple respectivamente. Cuando la cadena alifática se cierra formando un anillo, se denomina hidrocarburo alicíclico, hidrocarburo alifático cíclico o cicloalcano. • Los alcanos, alquenos y alguinos se distinguen porque en su nomenclatura utilizamos la terminación -ano -eno -ino respectivamente. La primera parte del nombre, el prefijo, nos indica el número de átomos de Carbono que constituyen la cadena. Por ejemplo Met-ano es un alcano de un sólo átomo, el prop-eno es un alqueno de tres átomos y el etino es un alquino de dos átomos. Los diez primeros prefijos son los siguientes:
- 9. Alcanos • También conocidos como de cadena abierta , constituidos por carbonos e hidrógenos unidos por enlaces sencillos. • Responden a la fórmula CnH2n+2 y para ciclo alcanos es CnH2n, de donde n es el número de carbonos. Para nominar a este tipo de hidrocarburos, se debe ver el número de carbonos que posea la cadena, de manera que podamos anteponer el prefijo griego (met, et, prop, but, etc), añadiendo la terminación –ano.
- 10. • El alcano más simple es el metano CH4.La molécula del metano es un tetraedro prefecto con ángulos de 109.5º.La distancia de enlace C-H es de 1.09 Å,la hibridaciñon sp3 en el átomo de carbono explica la estructura del metano.Cada enlace C-H se forma por solapamiento de un orbital sp3 del carbono con un orbital 1s hidrógeno. • El etano CH3-CH3 está compuesto por dos grupos metilo.Cada átomo de carbono presenta una hibridación sp3 y se une a los átomos de hidrógeno mediante un enlace s formado por solapamiento del orbital 1s del hidrógeno con un orbital sp3 del carbono.Ademas existe un enlace s C-C formado por el solapamiento de un orbital sp3de un carbono con el otro sp3 del otro átomo de carbono.
- 11. Las conformaciones de un compuesto son las diferentes disposiciones espaciales que pueden adoptar sus átomos por rotación alrededor de un enlace simple C-C. A cada conformación se le denomina "rotámero ó confórmero" y se interconvierten uno en otro por rotación alrededor de un enlace sencillo. Dos de ellas, llamadas conformación alternada y conformación eclipsada. • Alternada: es aquella en la que los enlaces C-H(R) están lo más alejados posibles. • Eclipsada: es aquella donde los enlaces C-H (R) están lo más cercano posible. ETANO BUTANO
- 13. Ejemplos
- 14. NOMENCLATURA Según la IUPAC: • Se designan por el sufijo -ano. • Los prefijos de los cuatro primero son metano,eteno,propano,butano. • A partir del quinto elemento se emplea el prefijo griego. • El isómero de cadena lineal,no ramificada,se designa anteponiendo la letra n a su nombre. • En cadenas ramificadas,se nombra la mas larga. • Los grupos sustituyentes reciben el nombre alquilo. l-4-etilnon2,4-dimetiano 3,4-dietilheptano
- 15. PROPIEDADES FÍSICAS •Los cuatro primeros términos de la serie son gases; del propano al heptano son líquidos; del octadecano en adelante son sólidos de aspecto céreo. •Los puntos de ebullición crecen al aumentar el peso molecular en los n-alc anos.En los isómeros disminuye al aumentar la ramificación. • El punto de fusión también aumenta con el peso molecular en los n-alcanos en tanto que los isómeros no hay una variación regular. Son insolubles en agua. •Los ciclo alcanos presentan mayor punto de fusión,ebullición y densidad.
- 17. SÍNTESIS 1).CONSERVANDO LA LONGITUD DE LA CADENA • Hidrogenación catalítica de alquenos (Adams): esta reacción se lleva acabo,calentando a reflujo y con agitación un alqueno en presencia del catalizador Pd o Pt metálico finamente dividido,que tiene hidrógeno adsorbiendo en su superficie. • Reducción de halogenuros de alquilo: esta reacción se llama de reducción por que se esta reemplazando un átomo muy electronegativo como es el Cl (3,0) por uno con electronegatividad semejante a la del carbono (2,5) como es el átomo de hidrógeno(2,25) y el carbono entonces comparte en un grado mayor los electrones del enlace. • Usando el reactivo de Grignard: el reactivo de Grignard se prepara a partir de un halogenuro de alquilo,usando éter anhidro como solvente en el que se disuelve el magnesio metálico.Se obtiene de esta manera un complejo organometálico donde la parte orgánica es una base muy fuerte,de un pKa de alrededor de 40.
- 18. 2). REDUCCIÓN DE COMPUESTOS CARBONÍLICOS.(C=O) • Método de Clemmensen (Medio ácido): este método reduce el compuesto carbonílico con Zinc amalgamado,obtenido al tratas previamente en el Zn metálico con una disolución acuosa de una sal de mercurio. • Método de Wolf-Kishner (Medio alcalino): en este método se calienta fuertemente y a reflujo el aldehído o la cetona con una solución alcalina de hidracina. (NH2-NH2) • Método de los tioacetales (Medio neutro): estos tres métodos de reducción son complementarios.Pueden ser usados específicamente cuando se corre el riesgo de efectar algún grupo funcional en alguna de las moléculas involucradas por acción del reactivo utilizado en la reducción.
- 19. 3). ALARGANDO LA CADENA • Método de Wurtz: este método sirve para sintetizar alcanos simétricos,es decir, solo debe usarse un halógenuro de alquilo en cada reacción. • Al utilizar una mezcla de halógenuros se obtiene como producto una mezcla de alcanos con la desventaja de disminuir el rendimiento de la reacción. • Método electrolítico de Kolbe: este método también sirve para obtener un alcano simétrico, y al usar dos ácidos en la reacción presenta las mismas desventajas que el método de Wurtz. El rendimiento en el producto que interesa pasar a ser menor que un 30%. • Método de Corey-Hause: es un excelente método para obtener cualquier alcano simétrico o asimétrico. No presenta ninguna de las desventajas de los otros métodos anteriores.
- 20. PROPIEDADES QUÍMICAS • Reacciones con oxígeno: todos los alcanos reaccionan con oxígeno en una reacción de combustión,si bien se torna más difícil de inflamar al aumentar el número de átomos de carbono.La ecuación para la combustión completa es: CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2 En ausencia de oxígeno suficiente,puede formarse monóxido de carbono o inclusive negro de humo, como se muestra a continuacón: CnH(2n+2) + ½ nO2 → (n+1)H2 + nCO,por ejemplo metano:CH4 + 2O2 → CO2 + 2H2O CH4 + O2 → C + 2H2O. • Reacciones con halógenos:los alcanos reaccionan con halógenos en la denominada reacción de halogenación radicalaria.Los átomos de hidrógeno del alcano son reemplazados progresivamente por átomos de halógeno.Los radicales libres son las especies que participan en la reacción, que generalmente conducen a una mezcla de productos.
- 21. • Gracking: la pirolisis o craqueo térmico es la fragmentacion de alcanos de cierto tamaño en otros de menor tamaño a elevadas temperaturas • Isomeración y reformado: son procesos en los que los alcanos de cadena lineal son calentados en presencia de un catalizador de platino.En la isomeración,los alcanos se convierte en sus isómeros de cadena ramificada. • Otras reacciones: Los alcanos reaccionan con vapor en presencia de un catalizador de níquel para producir hidrógeno.Los alcanos pueden ser clorosulfonados y nitrados,aunque ambas reacciones requieren condiciones especiales.La fermentación técnica.En la reacción de Reed, el dióxido de azufre y cloro convierten a los hidrocarburos en cloruros de sulfonilo, en un proceso inducido por luz.
- 22. Alquenos • Son hidrocarburos que tienen doble enlace carbono- carbono en su molécula, y por eso son denominados insaturados. El doble enlace tiene dos componentes: el σ y el π. La formula general es: CnH2n
- 23. Se les denomina también olefinas.El alqueno más simple es el etileno cuya fórmula molecular es C2H4.El doble enlace se representa en una estructura de Lewis, mediante dos pares de electrones entre los átomos de carbono.La longitud del enlace C=C en el etileno es de 1.33 Å, mucho mas corto que el enlace simple C-C del etano que es de 1.54 Å.La longitud del enlace C-H en el etileno es de 1.08 Å,ligeramente menor que el enlace C-H en el etano que es de 1-09 Å.
- 24. Las distancias y ángulos de enlace se pueden explicar admitiendo que los dos átomos de carbono que forman el doble enlace presentan una hibridación sp2 y que el doble enlace está constituido por un enlace s y un enlace p. El enlace s se forma por solapamiento de los orbitales sp2 de cada átomo de carbono. Cada uno de los enlaces C-H se forma por solapamiento de un orbital híbrido sp2 del carbono con el orbital 1s del hidrógeno.
- 26. • NOMENCLATURA Según la IUPAC: • Se cambia el sufijo -ano por -eno. • Se señala con un numero la posición del doble enlace. • La isomeria, hace necesaria la utilización de la terminología cis-trans(Z-E). • Selecciona la cadena mas larga que contenga el doble enlace o dobles enlaces. • Si hay dos o mas dobles enlaces,los números se anteponen al nombre principal añadiendo al sufijo -eno el prefijo di-, tri-, etc. • Se le da la numeración mas baja a los dobles enlaces. (Z)-3-Fluoro-2-metil-3-hexeno (E)-3-Propil-2,5-hexadieno
- 27. PROPIEDADES FÍSICAS • Los tres primeros términos de los alquenos son gases, hasta el numero dieciocho y los restantes son sólidos. • Son solubles en disolventes orgánicos mas no en agua. • Son incoloros.
- 29. SÍNTESIS • Los alquenos se pueden sintetizar de una de cuatro reacciones: • DESHIDROHALOGENACIÓN:CH3CH2Br + KOH → CH2=CH2 + H2O + KBr • DESHIDRATACIÓN: La eliminación de agua a partir de alcoholes,por ejemplo: CH3CH2OH + H2SO4 → CH3CH2OSO3H + H2O → H2C=CH2 + H2SO4 + H2O Tambien por la reacción de Chugaev y la reacción de Grieco. • DESHALOGENACIÓN: BrCH2CH2Br + Zn → CH2=CH2 + ZnBr2 • PIROLISIS (con calor): CH3(CH2)4 → CH2=CH2 + CH3CH2CH2CH3
- 30. PROPIEDADES QUÍMICAS • Hidrohalogenación: se refiere a la reacción con haluros de hidrógeno formando alcanos halogenados del modo CH3CH2=CH2 + HX → CH3CHXCH3.Por ejemplo,halogenación con el ácido HBr,Se da en estapas: Iniciación Propagación Terminación • Hidrogenación:se refiere a la hidrogenación catalítica usando Pt,Pd o Ni, formando alcanos del modo CH2=CH2 + H2 → CH3CH3.
- 31. • Halogenación: se refiere a la reacción con halógenos (representados por la X) del modo CH2=CH2 + X2 → XCH2CH2X.Por ejemplo,halogenación con bromo: • Polimerización:forma polímeros del modo CH2=CH2 → (-CH2-CH2-)n polímero,(polietileno en este caso). • Ozonolisis: reacción de los alquenos con el ozono formando ozónido. • Adición de HBr: se genera en presencia de un peróxido y se conoce como una reacción antimarkconikov.
- 32. Alquinos • Son hidrocarburos alifáticos que contienen un triple enlace entre dos átomos de carbono (no saturado), son compuestos metaestables debido a la alta energía del triple enlace carbono-carbono,su formula general es CnH2n-2. • Se les denomina también hidrocarburos acetilenos por que derivan del alquino más simple que se llama acetileno.La estructura de Lewis del acetileno muestra tres pares de electrones en la región entre los núcleos de carbono,H:C:::C:H(acetileno).
- 33. El acetileno tiene una estructura lineal que se explica admitiendo una hibridación sp en cada uno de los átomos de carbono, el solapamiento de dos orbitales sp entre sí genera el enlace σ C-C, por otra parte, el solapamiento de dos orbitales sp genera el enlace, por otra parte el solapamiento del orbital sp con el orbital 1s del hidrógeno forma el enlace σ C-H.Los dos enlaces π se originan por solapamiento de los dos orbitales p que quedan en cada uno de los átomos de carbono.
- 34. • La longitud del enlace C-C en el acetileno es de 1.20 Å y cada uno de los enlaces C-H tiene una distancia de 1.06 Å. Los dos enlaces, tanto el C-C como el C-H,son mas cortos que los enlaces correspondientes en el etano y en el etileno. El triple enlace es relativamente corto debido al solapamiento de los tres pares de electrones y al elevado carácter s de los orbitales hibridos sp (50% de carácter s), lo que aproxima más a los átomos de carbono que forman el enlace σ del acetileno.
- 36. NOMENCLATURA • Para nombrar los Alquino se emplea la terminación "ino" especificando el número de átomos de carbono de dicha cadena con un prefijo (et- dos, prop- tres, but- cuatro; pent- cienco; hex- seis; etc),Si hay varios triples enlaces, se indica con los prefijos di, tri, tetra...etc. • Cuando se nos presenta un alquino ramificado o arborecentes, se enumera la cadena mas larga como la principal ya se en forma lineal o en secuencia vertical u horizontal,empezando por el carbono mas cercano al triple enlace. La cadena se numera de forma que los átomos del carbono del triple enlace tengan los números más bajos posibles, se indican los radicales por orden alfabético anteponiendo el numero del atomo de carbono en el que se localiza. 4-Bromo-3,3-dimetil-1-butino 2-Metil-2-hexen-4-ino
- 37. PROPIEDADES FÍSICAS • Los tres primeros términos son gaseosos y los restantes líquidos o sólidos. • Presentan punto de ebullición y fusión algo superiores por el triple enlace. • A medida que aumenta el peso molecular aumenta la densidad, el punto de fusión y el punto de ebullición. • Insolubles en agua pero si en disolventes orgánicos. • Baja polaridad. • Son incoloros.
- 39. SÍNTESIS Los alquinos se pueden sintetizar de una de cuatro reacciones: • POR DESHIDROHALOGENACIÓN DE DIHALOGENUROS DE ALQUILO VECINALES (X:Cl,Br);Esta reaccion se lleva a efecto en un medio fuertemente básico.(NH2 -),usando amoniaco liquido como solvente. • POR DESHIDROHALOGENACIÓN DE DIHALOGENUROS DE ALQUILOS GERMINALES.(X:Cl,Br);Esta reacción también hace uso de una fase fuerte como el anión NH2-, en amónico líquido. • POR REACCIÓN ENTRE UN ALQUILURO Y UN HALOGENURO DE ALQUILO; A través de una reacción de desplazamiento nucleofílico del bromo por un alquiluro. • POR TRATAMIENTO EN ETAPAS DEL ACETILENO CON DIFERENTES HALOGENUROS DE ALQUILO;Aquí es utilizada la base fuerte NH2- para formar primero el anión acetiluro el que actuará en una segunda etapa como nucleófilo para desplazar al halogenuro.
- 40. PROPIEDADES QUÍMICAS • Oxidación: ocasiona la ruptura del triple enlace y la formación de ácido, para oxidar utilizamos KMnO4 (permanganato de potasio),KMnO4 permanganato de potasio,CH3OOH ácido etanoico, HCOOH ácido metanoico, MnO2 bióxido de manganeso, KOH hidróxido de potasio, H2O agua). El bióxido de manganeso se presenta como un precipitado de color carmel. • Halogenación: En esta reacción agregamos un halógeno al triple enlace, cuando utilizamos flúor debemos disminuir la temperatura al realizarla con cloro o bromo hay una fácil adición al triple enlace. • Adición de halogenuros de hidrógeno: consiste en adicionar un halogenuro de hidrógeno (HCL,HBr,HI); en la segunda etapa tenemos en cuenta la regla de Markovnicov. • Hidrogenación: consiste en agregar hidrógenos al triple enlace hasta convertirlo en un enlace sencillo, para realizarse la reacción es necesaria la presencia de un catalizador ( platino o níquel). • Combustión: es una reacción en los alquinos que provoca producción de llama.
- 41. Cíclicos • Son hidrocarburos, principalmente son alcanos, los cuales poseen sus extremos de la cadena unidos, lo cual hace que se forme un ciclo. Estos poseen 2 hidrógenos menos que el alcano del que estos se derivan. Los ciclo alcanos, tambie´n son compuestos que forman cadenas cerradas o anillos y se clasifican en monocíclicos (1 anillo) y policíclicos (2 o más anillos).
- 42. Características principales: • Pertenecen al Grupo funcional de los alcanos • Son hidrocarburos Saturados. • Su fórmula molecular es CnH2n. • Su nomenclatura utiliza el prefijo ciclo seguido del nombre del alcano. • Pueden ser ramificados. • Pueden tener sustituyentes inorgánicos que ocuparán el número del carbono en el que se encuentran unidos, como Na, K, los cuales ocuparían el lugar del hidrógeno. • Son tan reactivos como los alcanos que poseen cadena abierta. • El cicloalcano más pequeño tiene 3 carbonos dentro del ciclo y el más grande tiene 6 carboos (debido a su estabilidad angular, ya que forman un ángulo de 109° al igual que el metano). • Aparecen en la naturaleza como parte del petróleo. • Hormonas como los estrógenos, colesterol, progesterona y testosterona presentan varias de estas estructuras cíclicas unidas. Los principales cicloalcanos que se en la naturaleza son:
- 43. • Ciclopropano Esta formado por 3 carbonos, es el cicloalcano más simple de todos, es plano, como sus ángulos se encuentran muy unidos, presentan mucha tensión angular, esto hace que una estructura le tape a otra y se forman enlaces banana, ya que son anchos y poseen forma de banana.
- 44. • Ciclobutano Esta formado por 4 carbonos,este no es plano, este posee enlaces alternados, unos con 109° y otros de 88°
- 45. • Ciclopentano Está formado por 5 carbonos, es uno de los cicloalcanos más estables, la tensión angular en este ciclo es casi mínima ya que forma ángulos de 109,5°, su esqueleto o estructura es ligeramente plegada, por lo tanto sus estructuras se eclipsan.
- 46. • Ciclohexano o benceno Está formado por 6 carbonos, es el cicloalcano más estable ya que este no tiene tensión angular, es uno de los más abundantes en la naturaleza y lo tenemos presente en el colesterol.
- 47. • Ciclo octano Está formado por 8 carbonos.
- 48. Aromáticos • Con este nombre se conocen todos los compuestos derivados del benceno, cuya estructura se muestra a continuación: • El benceno (C6H6) es un compuesto cíclico de forma hexagonal, compuesto por 6 átomos de carbono y 6 de hidrógeno y tres dobles enlaces alternados. Cada vértice del hexágono, representa un átomo de carbono, al cual está unido un hidrógeno para así completar los cuatro enlaces del carbono. • El benceno es un líquido volátil, incoloro, inflamable, insoluble en agua y menos denso que ella. Se disuelve en disolventes orgánicos como alcohol, acetona y éter entro otros. Es de olor fuerte pero no desagradable, hierve a 80.1°C y se funde a 5.4 °C. Se obtiene mediante la destilación fraccionada del alquitrán de hulla y es utilizado como solvente de resinas, grasas y aceites; es tóxico y resulta peligroso respirar sus vapores por periodos largos. BENCENO
- 49. Propiedades y usos de compuestos aromáticos • Los derivados del benceno se forman cuando uno o más de los hidrógenos son reemplazados por otro átomo o grupo de átomos. Muchos compuestos aromáticos son mejor conocidos por su nombre común que por el sistémico. A continuación se muestran algunos de los derivados monosustituídos más comunes junto con sus características más importantes. El nombre con mayúsculas es su nombre común. El nombre sistémico se presenta entre paréntesis. Las reglas de estos nombres se explicarán más adelante. • Algunos derivados aromáticos están formados por 2 o 3 anillos y les conocen como policíclicos..
- 53. Nomenclatura de compuestos aromáticos disustituídos.- • La terminación sistémica de los compuestos aromáticos es benceno, palabra que se une al último sustituyente. • En los compuestos disustituídos, dos átomos de hidrógeno han sido reemplazados por radicales alquilo, átomos de halógenos o algún otro grupo funcional como –OH (hidroxi), –NH2 (amino) o –NO2 (nitro) que son los que se utilizarán en los ejemplos. • Los sustituyentes pueden acomodarse en 3 posiciones diferentes. Para explicarlas utilizaremos un anillo aromático numerado en el siguiente orden:
- 55. Grupos funcionales • Un átomo o grupo de átomos que representan la diferencia entre un hidrocarburo y el nuevo compuesto, se le llama grupo funcional. • Pdecir que un grupo funcional es un átomo o grupo de átomos que caracteriza a una clase de compuestos orgánicos. • Cada grupo funcional determina las propiedades químicas de las sustancias que lo poseen; es decir determina su función química. • Entonces, se llama función química a las propiedades comunes que caracterizan a un grupo de sustancias que tienen estructura semejante; es decir, que poseen un determinado grupo funcional.
- 56. • En un alcano, los átomos de hidrógeno pueden ser sustituidos por otros átomos (de oxígeno o nitrógeno, por ejemplo), siempre que se respete el número correcto de enlaces químicos (recordemos que el oxígeno forma dos enlaces con los otros átomos y el nitrógeno forma tres). El grupo OH en el alcohol etílico y el grupo NH2 en la etilamina son grupos funcionales.
- 57. Los principales grupos funcionales son los siguientes: • Grupo hidroxilo (– OH) Es característico de los alcoholes, compuestos constituidos por la unión de dicho grupo a un hidrocarburo (enlace sencillo). • Grupo alcoxi (R – O – R) Grupo funcional del tipo R-O-R', en donde R y R' son grupos que contienen átomos de carbono, estando el átomo de oxígeno en medio de ellos, característico de los éteres (enlace sencillo). (Se usa la R ya que estos grupos de átomos constituyen los llamados radicales) • Grupo carbonilo (>C=O) Su presencia en una cadena hidrocarbonada (R) puede dar lugar a dos tipos diferentes de sustancias orgánicas: los aldehídos y lascetonas. En los aldehídos el grupo C=O está unido por un lado a un carbono terminal de una cadena hidrocarbonada (R) y por el otro, a un átomo de hidrógeno que ocupa una posición extrema en la cadena. (R–C=O–H) (enlace doble). En las cetonas, por el contrario, el grupo carbonilo se une a dos cadenas hidrocarbonadas, ocupando por tanto una situación intermedia. (R–C=O–R) (enlace doble).
- 58. Es el grupo funcional característico de los ácidos orgánicos. Los ácidos orgánicos reaccionan con los alcoholes de una forma semejante a como lo hacen los ácidos inorgánicos con las bases en las reacciones de neutralización. En este caso la reacción se denomina esterificación, y el producto análogo a la sal inorgánico recibe el nombre genérico de éster. Puede considerarse como un grupo derivado del amoníaco (NH3) y es el grupo funcional característico de una familia de compuestos orgánicos llamados aminas. Funciones oxigenadas A continuación, un cuadro resumen de los grupos funcionales (con su correspondiente función química) donde participan átomos de carbono, hidrógeno y oxígeno. Presencia de algún enlace carbono-oxígeno: sencillo (C-O) o doble (C=O)
- 59. • Importante: • Nótese que en las funciones alcohol y éter hay sólo enlaces sencillos (de la forma C – O), en cambio en todas las otras funciones oxigenadas hay enlaces dobles (de la forma C = O). Este aspecto es muy importante para definir el número de átomos de hidrógeno que tiene algún compuesto químico
- 60. Funciones nitrogenadas • A continuación, un cuadro resumen de los grupos funcionales (con su correspondiente función) donde participan átomos de carbono, hidrógeno y nitrógeno. • Presencia de enlaces carbono-nitrógeno, simples (C – N), dobles (C = N) o triples (C ≡ N)
- 62. Funciones halogenadas • A continuación, un cuadro resumen de los grupos funcionales donde participan átomos de carbono, hidrógeno y elementos halógenos. • Compuestos por carbono, hidrógeno y halógenos.