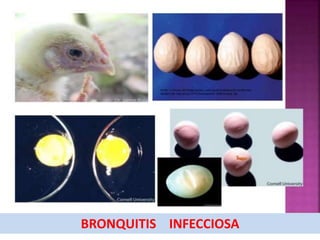
Bronquitis infecciosa: agente, hospederos, transmisión y signos
- 2. AGENTE ETIOLÓGICO El IBV es un miembro de los Coronaviridae, que incluye dos géneros, el Coronavirus y el Torovirus. Calnek, 2000; Rojo, 2003. La cepas mas conocidas son: • Massachusetts • Connecticut • JMK • Arkansas • Georgia • Gray • Holte • T. australiana • Doorn • D 207 • Delawere • New Hampshire
- 3. AGENTE ETIOLÓGICO • Es un virus RNA de una sola tira (Jordan-Pattison, 1998). • Ribonucleoproteina como tiras de solo 1-2 nm de diámetro, pero en ocasiones se aprecian estructuras helicoidales con 10-15 nm de diámetro • El IBV es pleomorfico, pero por lo general redondeado. • Envoltura de aprox. 120 nm de diámetro con proyecciones superficiales en forma de palo de golf (espículas) de casi 20 nm de longitud. Calnek, 2000 . Contiene tres principales proteínas: • S: Glucoproteínas de espícula • M: Membrana • N: Proteína de la nucleocápside interna
- 4. Resistencia a agentes físicos y químicos AGENTE ETIOLÓGICO Y supervivencia en el ambiente de hasta 12 días en el verano y de 56 días en invierno. Termoestabilidad Las cepas IBV son inactivadas después de 15 min. a 56ºC y después de 90 min. a 45ºC Liofilización El liquido alantoideo infeccioso liofilizado, sellado bajo vacío y almacenado en un refrigerador Viable por cuando menos 30 años Estabilidad en pH El IBV en cultivo celular resulto mas estable en un medio con un pH de 6.0-6.5, que a un pH de 7.0-8.0 Agentes químicos Es lábil al éter. Se destruye con cloroformo a 50% (temperatura ambiente, 10 minutos) y desoxicolato sódico a 0.1 % (4ºC, 18 horas). El IBV es sensible a los desinfectantes comunes. Calnek, 2000 .
- 5. HUÉSPEDES Afecta exclusivamente a la gallina domestica de cualquier edad. Puede atacar: • Aparatos respiratorios • Aparato reproductor • Aparato urinario Rojo, 2003.
- 6. HUÉSPEDES Embriones de pollo en desarrollo También se ha sido aislado en palomas y faisanes Quinn et al, 2002. Calnek, 2000.
- 7. VÍAS DE TRANSMISIÓN HORIZONTAL Aerosoles de gallinas enfermas o portadoras Corrientes de aire, cerca de 400 metros. Personas con equipos contaminados Calnek, 2000; Rojo, 2003. La transmisión vertical no es importante en la difusión de esta enfermedad. (Quinn et al, 2002).
- 8. PATOGENIA El lugar primario de la replicación vírica es la tráquea. Lleonart et al, 1991. De forma natural la infección se presenta en 1 o 2 días. También se replica en: • Los pulmones • Riñones • Ovarios • Tejido linfoide Fenner et al, 1992. Empiezan a presentarse nuevos virus de 3 a 4 horas después de la infección, alcanzándose una producción máxima por célula dentro de las 12 horas a 37ºC. Calnek, 2000. La distribución y la gravedad de las lesiones producidas en los tejidos Dependen de la virulencia de la cepa infectante (Quinn et al, 2002).
- 9. PATOGENIA En huéspedes experimentales El periodo de incubación de la BI es de 18 a 36 horas. Dependiendo la dosis y vía de inoculación Los pollos expuestos a un aerosol de liquido infectado sin diluir. Tienen de manera regular estertores traqueales Dentro de 24 horas Calnek, 2000. En polluelos recién nacidos Ocasiona cierta mortalidad Al aumentar la edad, los pollos se vuelven mas resistes a: • Los efectos nefritogénicos • Lesiones del oviducto • Mortalidad a causa de la infección
- 10. PATOGENIA En los pollos jóvenes Tiene una duración de 7 a 21 días Dependiendo la gravedad del proceso El IBV puede producir infecciones persistentes en algunos pollos Dando lugar a la eliminación del virus en las heces durante varios meses Después de la exposición inicial al virus Cuando persiste el virus en presencia de altos títulos de anticuerpos Puede producirse una nefritis grave. Proceso mediado por complejos inmunes. Fenner et al, 1992.
- 11. SIGNOS • Depresión • Perdida de apetito • Retraso en el crecimiento • Agrupación bajo la fuente de calor (Calnek, 2000). Respiratorios: • Estertores traqueales • Jadeo • Estornudos • Descargas nasales acuosas • Disnea (boqueo) Algunas veces acompañadas por: • Lagrimeo • Inflamación facial (ojos llorosos) Jordan-Pattison, 1998; Rojo, 2003 y Fenner et al, 1992
- 12. SIGNOS Respiratorios: • Muerte por la oclusión de sus bronquios. Reproductivos: En gallinas ponedoras • Mala calidad del cascaron (delgado, rugoso, despigmentado, deforme, etc.) • Albuminas acuosas, sin diferenciación con la albumina espesa • Baja fertilidad e incubabilidad del huevo. (Quinn et al, 2002). Rojo, 2003.
- 13. SIGNOS Renales: • Deyecciones blancas (por la presencia de uratos). • Deshidratación • Plumas manchadas de blanco alrededor de la cloaca • Poliuria Rojo, 2003.
- 14. SIGNOS Embriones de pollo en desarrollo: • Embrión enroscado en forma esférica • patas deformadas y comprimidas sobre la cabeza • Amnión engrosado y adherido. Calnek, 2000 .
- 15. LESIONES • Exudado seroso, catarral o caseoso en la tráquea, fosas nasales y senos. • Sacos aéreos pueden tener aspecto turbio o contener un exudado caseoso amarillo y engrosadas. • Congestión de los pulmones MACROSCÓPICAS Respiratorias: • Asfixia en pollos jóvenes • Inflamación con enrojecimiento de los anillos traqueales en pollos mas viejos Forma mas grave: • Tapón caseoso en la parte inferior de la tráquea o en los bronquios. Causan: Calnek, 2000; Jordan-Pattison, 1998. Traqueítis catarral
- 16. LESIONES MICROSCÓPICAS Respiratorios El marcado engrosamiento subepitelial presenta: • Edema • Infiltración de la lamina propia con monocitos y linfocitos • Perdida de las glándulas mucosas La tráquea y los bronquios muestran: • Perdida de cilios con hiperplasia epitelial y metaplasia. • A menudo con encostramiento de las células superficiales Jordan-Pattison, 1998
- 17. LESIONES MACROSCÓPICAS Reproductivas En oviducto funcional: • Material liquido de yema en la cavidad abdominal (Calnek, 2000). • Regresión en tamaño con metaplasia del epitelio. • Dilatación glandular • Infiltración de tejido subepiteliales con monocitos • Proliferación de folículos linfoides • Fibroplasia tardía Jordan-Pattison, 1998
- 18. LESIONES En pollos muy jóvenes: • Ausencia casi total del conducto • Vestigios obstruidos o quistes hasta un oviducto, cuya estructura y función es solo ligeramente, poco frecuente, subnormal. MACROSCÓPICAS Reproductivas • Hipoplasia del epitelio y las glándulas tubulares. A menudo se presenta: • Obliteración de la luz. MICROSCÓPICAS Reproductivas Jordan-Pattison, 1998
- 19. LESIONES Renales • Riñones hinchados y pálidos • Los túbulos y uréteres a menudo distendidos por uratos. Calnek, 2000. • Infiltración linfocítica intersticial • Necrosis del epitelio tubular con acumulación de uratos • Material necrótico en la luz En los uréteres • Metaplasia • Necrosis del epitelio con encostramiento dentro de la luz. Jordan-Pattison, 1998. Jordan-Pattison, 1998.
- 20. LESIONES Embriones de pollo en desarrollo • Saco vitelino parece encogido y la membrana se rompe con facilidad • La membrana corioalantoica (MCA) y la membrana amniótica edematosas. Lesión interna del embrión infectado con BI • Persistencia del mesonefro con uratos Calnek, 2000 .
- 21. MICROSCÓPICAS • Congestión con manguitos perivasculares • Cierto grado de necrosis hepática (sexto día después de la inoculación) LESIONES Embriones de pollo en desarrollo En riñones: • Nefritis intersticial con edema • Distención de los túbulos contorneados proximales con moldes En pulmones: Neumónicos, caracterizados por: • Congestión • infiltración celular • Exudado seroso en los sacos bronquiales Calnek, 2000 .
- 22. DIAGNOSTICO Las características clínicas y lesiones macroscópicas e histológicas pueden ser sugerentes. TÉCNICAS DE LABORATORIO: 1. Aislamiento viral: El principal objetivo del IBV es la tráquea (sitio preferido para las muestras) Consiste en: • Inoculación en embriones de pollos o en cultivos de órgano traqueal. 2. Confirmación del IBV por métodos basados en anticuerpos. • Examinación de los cortes o raspados de la mucosa traqueal y otros tejidos mediante: • Pruebas de Inmunofluorescencia o inmunoperoxidasa. Calnek, 2000 .
- 23. DIAGNOSTICO 3. Confirmación del IBV por métodos basados en el acido nucleico • Detección de RNA del IBV en tejidos infectados • Extrayendo muestras traqueales o tisulares de pollos vivos viables al IBV. • Utilizando el método de transcriptasa inversa/reacción en cadena de la polimerasa. 4. Serología • Valoraciones de anticuerpos en el suero Ya sea con: • Prueba de ELISA • NV (Neutralización de Virus) • IH (Inhibición de la Hemaglutinación) Calnek, 2000 .
- 24. DIAGNOSTICO 5. Hemoaglutinación indirecta • Utilizando glóbulos rojos de caballo tratados con acido tánico Rojo, 2003. 6. Agar gel precipitación • Útil para determinar la presencia o ausencia de anticuerpos de BI Lleonart et al, 1991.
- 25. DIAGNOSTICO DIFERENCIAL Cuadro respiratorio: • Enfermedad de Newcastle tipo Hitchner (requiere forzosamente laboratorio para su diferenciación) • Coriza infecciosa • Laringotraqueítis aviaria • Enfermedades respiratorias crónica La BI puede confundirse clínicamente: Cuadro reproductivo: • Enfermedad de Newcastle tipo Beaudette, Beach o Doyle • Síndrome de la baja postura • Deshidratación Rojo, 2003. Coriza infecciosa Laringotraqueítis
- 26. DIAGNOSTICO DIFERENCIAL Cuadro renal: • Infección de la Bolsa de Fabricio en aves jóvenes • Micotoxicosis • Deshidratación • Intoxicación por sulfas Rojo, 2003.
- 27. TRATAMIENTO Para la Bronquitis Infecciosa. • La administración de antibióticos puede reducir la mortalidad asociada a las infecciones bacterianas. Factores de manejo para ayudar a reducir las perdida por IB • Proporcionar calor adicional para eliminar el estrés por frio. • Evitar el hacinamiento. • Conservar la ingestión de alimentos para prevenir perdidas de peso. Calnek, 2000. Quinn et al, 2002. Calnek, 2000.
- 28. TRATAMIENTO Tratamiento para compensar la perdida aguda de sodio y potasio y perdidas por nefritis, es recomendable: • Concentración de 72 miliequivalentes de sodio, potasio, o ambos, con cuando menos una tercera parte de bicarbonato o sal de citrato. Calnek, 2000.
- 29. CONTROL, PREVENCIÓN Y ERRADICACIÓN • Calendario de vacunación adecuado a la zona • No se vacuna sobre brote, por la rapidez con que se difunde la enfermedad. Inmunización: • Las cepas utilizadas son las Massachusetts y la Connecticut combinadas. • O únicamente la Massachusetts Las vacunas vivas suelen administrar en el agua de bebida o mediante nebulización a pollitos de hasta 14 días de edad y de nuevo hacia las 4 semanas de edad VACUNACIÓN: Rojo, 2003. Rojo, 2003. Quinn et al, 2002. Nebulización
- 30. Esquema de vacunación frente a Bronquitis infecciosa para pollitas de recría Primer día de edad Serotipo Massachusetts cepa H-120 spray 8-10 semanas Serotipo D-212, cepa D-1466 Óculo-nasal o spray 10-14 semanas Serotipo D-207, cepa D-274 Óculo-nasal o spray 16-20 semanas Vacuna inactiva con los 3 serotipos Vía intramuscular o subcutánea. Lleonart et al, 1991. CONTROL, PREVENCIÓN Y ERRADICACIÓN
- 31. CONTROL, PREVENCIÓN Y ERRADICACIÓN Por aspersión: • Mayor reacción posvacunal. Ocular y oral: • Administración combinada de la vacuna contra la enfermedad de Newcastle Rojo, 2003. También se le puede aplicar una vacuna inactivada por vía intramuscular varias semanas antes del punto de postura Jordan-Pattison, 1998. Rojo, 2003.
- 32. BIBLIOGRAFÍAS ♣ Jordan, F. T. y Pattison, M. 1998. Enfermedades de las aves. (3º ed.). Ed. Manual Moderno. México, D.F. p. 171-177. ♣ Calnek, B. W. 2000. Enfermedades de las aves. (2º ed.). Ed. Manual Moderno. México, D. F. p. 523- 534. ♣ Lleonart, F., Roca, E., Callís, M., Gurri, A. y Pontes, M. 1991. Higiene y patología aviares. Ed. Real Escuela de Avicultura. ESPAÑA. p. 154-160 y 379-380. ♣ Fenner, F., Bachmann, P. A., Gibbs, P. E., Murphy, F. A., Studdert, M. J., White, D. O. 1992. Virología veterinaria. Ed. Acribia, S. A. Zaragoza, España. p. 532-535. ♣ Rojo, E. M. 2003. Enfermedades de las aves. (2º ed.). Ed. Trillas. México, D. F. p. 40-46. ♣ Quinn, P. J., Markey, B. K., Carter, M. E., Donnelly, W. J., Leonard, F. C. 2002. Microbiología y enfermedades infecciosas veterinarias. Ed. Acribia, S. A. Zaragoza, España.
- 34. HEPATITIS POR CUERPOS DE INCLUSIÓN Afecta a pollos en crecimiento muy poco a aves de postura. Se da en pollos de 5 a 7 sem. de edad, o también puede atacar entre 2 y 15 sem. Secaracteriza por presentar hepatitis necrosante multifocal e hidropericardio.
- 35. ETIOLOGÍA Familia: Adenoviridae Género: Avidenovirus tipo 1 Se replican dentro del núcleo celular y producen cuerpos de inclusión basófilos. Existen 12 serotipos ( 1- 12) los mas virulentos son 1, 2, 4, 8. Virus con doble cadena de ADN. Existen 5 serogrupos: A, B, C, D, E Carecen de lípidos por eso son resistentes al éter y sensible a yodo, cloro, etc.
- 36. TRANSMISIÓN VERTICAL Virus infecta el ovario hasta empezar la postura. Ante estrés se reactiva este tipo de transmisión. HORIZONTAL Mediante heces y secreciones naso – orales. Aves portadoras y diseminación por fómites. Mforos.com
- 37. PATOGENIA VO con replicación en tracto gastrointestinal. Virus penetra al torrente sanguíneo por la vena cava superior. 24h postinfección hay viremia, llegando a hígado, corazón, páncreas, bazo, timo. Células hepáticas dañadas con partículas virales van al torrente sanguíneo ocasionando una 2° viremia. Virus invade BFy vesícula Biliar. Virus permanece en el ave por toda la vida.
- 39. Periodo de incubación de 24 a 48 h. Adenovirus pueden permanecer latentes en reproductoras hasta la madurez sexual y luego reactivarse en momentos de inmunosupresión y estrés y se transmite por vía vertical a la progenie. Infección horizontal origina la vertical en reproductoras hasta tressem. Mas donde las aves crean inmunidad y cesa la transmisión vertical. Mortalidad de 4 a 40% 2 a 3 días pos infección, masalta en aves jóvenes con mayor morbilidad en aves depostura.
- 40. SIGNOS CLÍNICOS • Depresión • Piel pálida • Somnolencia • Pelaje erizado • Diarrea blanquecina – verdosa • Anemia • Postración • Disnea jstor.org
- 41. LESIONES ANATOMOPATOLOGICAS • Piel ictérica con equimosis en mus. Pectoral, piernas y membranas serosas. • Grasa se torna amarillenta. • Hepatomegalia • Hígado amarillento, lóbulos pálidos y friables con focos necróticos • Riñones tumefactos pálidos con uratos en uréteres • Medula ósea pálida • Esplenomegalia • Hemorragia en intestinos y vísceras • BFatrófica • Edema pulmonar • Congestión generalizada • Hidropericardio y focos necróticos en miocardio
- 42. LESIONES Hígado amarillento, lóbulos pálidos y friables. jornadasavicultura.co m, 2012
- 43. Hidropericardio elsitioavicola.com Riñones están agrandados, pálidos y presentan pequeñas hemorragias petequiales. elsitioavicola.com Fluido seroso amarillento (hasta 10 ml), congestión y edema pulmonar.
- 44. DIAGNÓSTICODIFERENCIAL Por anemia y hemorragias Intoxicación por sulfa Síndrome hemorrágico Deficiencia de vit K www.elsitioavicola.com
- 45. DIAGNÓSTICODIFERENCIAL Por depresión y signos inespecíficos Aflatoxinas Los cuerpos de inclusión intranuclear son la diferencia.
- 46. DIAGNÓSTICO Por la alta mortalidad, grasa amarillenta, hidropericardio, cuerpos de inclusión intranuclear en los hepatocitos. SEROLÓGICO Pruebas en agar gel, ELISA, pruebas de virus – neutralización. PCR
- 47. • Emplear estrictas medidas sanitarias. • No rehusar camas. • Usar programas “todo adentro todo afuera”. • Reducir factores estresantes al mínimo. • Usar ingredientes alimenticios libres de toxinas, micotoxinas. www.aphis.usda.gov
- 48. • Contiene el adenovirus aviar grupo I, serotipo 4, es inactivada. DOSIS • 0.5 ml por vía subcutánea en el tercio medio posterior del cuello reproductoras después de las 10 o 12 semanas de edad, lo mejor a la sem 18.
- 49. • Incluye serotipo 4 y 8 de Adenovirus, reproducidos en embriones libres de agentes patógenos. Es una vacuna inactivada DOSIS • 0.5 ml por vía subcutánea en el tercio medio posterior del cuello en aves de primera semana
- 50. • Contiene virus inactivado y concentrado de la enfermedad de Newcastle cepa LaSotay adenovirus grupo1 serotipo 4 dela HCI e inmunoestimulantes que confieren una inmunidad alta yde larga duración. • recomendada para vacunar y revacunar aves de 1 día de edad o mayores, como auxiliar en la prevención y control de la ENCy de la HCI. DOSIS • 0.5 ml por via SC en el tercio medio posterior del cuello en aves de primera semana
- 51. SÍNDROME DE LA BAJA POSTURA EN AVES PONEDORAS
- 53. Transmisión. El virus se propaga a través del huevo a la progenie (principalmente en la primera etapa de la postura), de fómites contaminados por heces, por insectos, por la vacunación y cuando se toman muestras de sangre. La difusión es lenta si hay pocos portadores.
- 54. Periodo de incubación. Es variable, aunque puede durar de seis a doce semanas. Morbilidad variable (aprox. 50%). Mortalidad nula.
- 55. Se presentan los siguientes signos: •Disminuye la producción de huevo. •Huevos deformes. •Cascarones delgados o rugosos. cual las gallinas pueden •Huevos sin cáscara, luego de lo presentar una pérdida temporal de la movilidad, con recuperación. •Despigmentación de los huevos color café. •Albúmina acuosa y opaca. •Aves aparentemente sanas. •Ocasionalmente hay diarrea ligera. •La postura vuelve a sus valores normales en seis a doce semanas. Síntomas.
- 56. Huevos con el síndrome de la baja postura
- 57. Lesiones Se observa un ligero edema del tracto digestivo y del oviducto.
- 58. Diagnóstico diferencial. •Bronquitis infecciosa. •Micoplasmosis. •Enfermedad de Newcastle. •Problemas nutricionales.
- 59. Control Algunos medios para controlar la enfermedad son: ❖ Detectar portadores y eliminarlos. ❖ Incubar huevos únicamente de aves mayores de 40 semanas de edad, libres de anticuerpos, ya que después de esa edad difícilmente eliminan el virus por huevo. ❖ Evitar contaminaciones con heces. Usar la vacuna.
- 60. Prevención ➢ Vacunar a aves reproductoras entre las 14 y 18 semanas de edad, virus inactivado cepa 127 ó BC- 14, por vía intramuscular o subcutánea. En áreas de alto desafío se puede vacunar las aves durante el período de postura. ➢ También existen vacunas polivalentes de Newcastle-bronquitis infecciosa-síndrome de baja postura.
- 63. DEFINICIÓN La laringotraqueitis infecciosa aviar (VLTI) es una enfermedad respiratoria aguda, altamente contagiosa que afecta a pollos de todas las edades; puede resultar en pérdidas productividad graves en la debida a la mortalidad y menor producción de huevos en gallinas.
- 64. SINÓNIMOS Descrita como: a) Laringotraqueítis b) Laringotraqueítis infecciosa c) Difteria aviar (error) d) Bronquitis infecciosa (error)
- 65. HISTORIA Esta enfermedad fue descrita por vez primera en 1925, existen reportes de que pudo haber existido antes de este año. En 1930 se utilizó el término laringotraqueitis y en 1931 se adoptó la denominación de laringotraqueitis infecciosa por el Comité Especial de Enfermedades de Aves de la Asociación Médico Veterinaria Norte Americana.
- 66. HISTORIA 1934, Brandly y Bushnell idearon un método para la inmunización de pollos basada en la aplicación de virus virulento a la cloaca; importancia para la viral que siendo laringotraqueitis la primera enfermedad de se desarrollo una vacuna efectiva.
- 67. HISTORIA EN ECUADOR La investigación realizada por la Universidad San Francisco de Quito - USFQ, como proyecto de postgrado. (marzo 2011 - marzo 2012). Las muestras fueron recolectadas de granjas ubicadas en 7 provincias del país, resultando aves positivas en granjas ubicadas en las provincias de: Cotopaxi, Tungurahua y La Concordia. 3 focos positivos VLTI, bajo PCR (reacción en cadena de la polimerasa).
- 68. OCURRENCIA Y RELEVANCIA ECONÓMICA Laringotraqueitis se distribuye en todo el mundo, pero es con frecuencia regional en prevalencia o incidencia estacional. LT con resultados: crecimiento conversión alimenticia bajo el rango con elevada mortalidad en Broiler. Disminución de la producción de huevos se produce tras la exposición de los lotes maduros susceptibles.
- 69. OCURRENCIA Y RELEVANCIA ECONÓMICA Las cepas LT son de moderadas a fuertes con resultados con mayor morbilidad y la mortalidad en gallinas y pollos con una pérdidas de hasta 50%, la misma que es concurrente con el estrés ambiental y otras infecciones. Disminución de la producción de huevos se produce tras la exposición de los lotes maduros susceptibles.
- 70. AGENTE ETIOLÓGICO El agente causal de la laringotraqueítis es un virus ADN con envoltura. Familia: Herpesviridae Subfamilia: Alphaherpesvirindae Género: Varicellovirus Especie:Gallid herpesvirus 1
- 71. Sólo hay un tipo antigénico y éste afecta únicamente al aparato respiratorio de las aves con virulencia variable entre cepas. -Los herpesvirus son frágiles a las condiciones medio ambientales. -El virus se inactiva por el calor cuando está expuesto a 55º C por 15 min. o 38º C por 72 horas. CARACTERÍSTICAS DEL AGENTE ETIOLÓGICO
- 72. CARACTERÍSTICAS DEL AGENTE ETIOLÓGICO -El VLT se inactiva en menos de 1 min. con soluciones de cresol al 3% o por acción de una solución de soda cáustica (NaOH) al 1%. El precalentamiento de los galpones por 3 días a 37,8º C, disminuye la carga viral o la inactivación del virus.
- 73. Las superficies pueden ser fácilmente descontaminadas con los desinfectantes iodóforos o las mezclas de halógenos y detergentes. VLT fue obtenida La inactivación completa de la contagiosidad del con peróxido de hidrógeno al 5%. CARACTERÍSTICAS DEL AGENTE ETIOLÓGICO
- 74. ESPECIES SUSCEPTIBLES Los pollos son los huéspedes naturales primarios afectados. Aunque la enfermedad afecta todas las edades, los signos más característicos se observan en aves adultas. Puede afectar a los faisanes, las perdices y los pavos. El virus de LTV, no causa infección en humanos.
- 75. PATOGENIA Se debe tener en cuenta que la excreción viral ocurre uno a dos días antes de la aparición de los signos clínicos. El período de incubación de la VLTI es generalmente de 6 a 12 días.
- 76. PATOGENIA
- 77. TRANSMISIÓN El virus ingresa al organismo a través de la vía respiratoria ó a través de la conjuntiva y se encuentra principalmente en la tráquea y exudados de las vías aéreas superiores. La infección se transmite por contacto directo con exudados respiratorios expectorados o aerosoles.
- 78. TRANSMISIÓN Las aves también pueden infectarse a través del personal, los visitantes y los equipos contaminados; los perros, las ratas y los pájaros también pueden actuar como vectores mecánicos.
- 79. REPLICACIÓN Y LATENCIA La replicación activa del VLT ocurre en la tráquea durante la primera semana posterior a la infección. La eliminación viral es máxima durante los 7 a 10 días posteriores a la aparición de los primeros signos clínicos.
- 80. REPLICACIÓN Y LATENCIA A partir del fin de la excreción viral activa, se establece una fase de infección latente en el tejido nervioso, particularmente por invasión del virus al ganglio trigémino, y la tráquea.
- 81. Nervio trigemino
- 82. Replicación viral 1. Fijación a receptores de la célula 2. Fusión de envoltura con membrana del huésped 3. Nucleocápside pasa al citoplasma de allí transportada a membrana nuclear 4. DNA liberado rige la actividad del núcleo 5. Transcripción y replicación
- 83. REPLICACIÓN Y LATENCIA °°Demostrado por re-aislamiento del virus a partir de la séptima semana después de la infección mediante hisopados traqueales repetidos, y a dos meses después de la infección a partir de cultivos de tráquea. La infección latente es el mecanismo de subsistencia donde el virus evade la respuesta inmune del huésped y persiste en las parvadas o lotes.
- 84. REACTIVACIÓN DE INFECCIONES LATENTES El estado de latencia del virus es por lo tanto de gran importancia epidemiológica. Aunque las aves que sobreviven a desafortunadamente la enfermedad son inmunes, son portadoras sanas y pueden permanecer infectivas hasta por dos años y continuar excretando el virus en forma intermitente.
- 85. RESPUESTA INMUNE La respuesta por anticuerpos neutralizantes del virus se detecta en suero dentro de los 5 a 7 días posteriores a la infección. Esta respuesta inmune se mantiene en bajos niveles por un año o más Los anticuerpos maternales para la LTI no protegen a la descendencia contra la infección ni interfieren con la vacunación
- 86. CUADRO CLÍNICO • Cuadro agudo, con elevada morbilidad (90%) y letalidad del 10-20-70% (muy variable). • Disnea, jadeos y tos (expectoración de sangre). • Secreción nasal, conjuntivitis, cianosis de la cabeza. • Muerte a los pocos días por asfixia o recuperación en 2-3 semanas. • Caída de la puesta transitoria, recuperación a valores normales sin pérdida de calidad.. • Virulencia alta
- 87. CUADRO CLÍNICO • Virulencia alta
- 88. CUADRO CLÍNICO • Cuadro leve, con baja morbilidad y letalidad (2-5%). • Complicaciones bacterianas Signos respiratorios de menor intensidad: ▪ conjuntivitis ▪ exudado nasal ▪ edema de párpados ▪ ruidos respiratorios y sacudidas de cabeza Disminución de la producción de huevos sin pérdida de la calidad. • Virulencia media o baja
- 89. LESIONES • Edema sinusal. • Inflamación mucopurulenta de laringe y tráquea con hemorragias, necrosis y formación de membranas difteroides. • Coágulos sanguíneos en tráquea en fases terminales (hallazgo significativo). • No suelen estar afectados pulmones ni sacos aéreos.
- 90. LESIONES Microscópicamente: cuerpos de inclusión IN en células epiteliales en los primeros días y descamación posterior del epitelio necrótico. •Regeneración total del epitelio hacia los 10-12 días de la infección.
- 92. Edema facial:
- 95. Disnea con extensión del cuello
- 96. Traqueítis hemorrágica, taponamientos caseosos
- 97. Traqueítis hemorrágica, taponamientos caseosos
- 98. Traqueítis hemorrágica, taponamientos caseosos
- 99. Traqueítis hemorrágica, taponamientos caseosos
- 100. TÉCNICAS DE DIAGNÓSTICO a) Aislamiento del virus b) Microscopía electrónica c) Immunofluorescencia d) Inmunodifusión en gel de agar e) Enzimoinmunoensayo f) Histopatología g) Métodos moleculares a) Protocolo de la PCR b) PCR en tiempo real c) Polimorfismo de longitud de los fragmentos de restricción (RFLP) Identificación del agente
- 101. TÉCNICAS DE DIAGNÓSTICO a) Neutralización vírica b) Inmunodifusión en gel de agar c) Prueba de inmunofluorescencia indirecta d) Enzymoinmunoensayo Pruebas serológicas
- 102. DIAGNÓSTICO En epizootias de la forma aguda o típica: observa la alta letalidad, los síntomas respiratorios (disnea inspiratoria y traqueítis hemorrágica). campo es correcto con un El diagnóstico presuntivo de % elevado de los casos.
- 103. DIAGNÓSTICO DIFERENCIAL Además su característica principal es la descamación de traqueales que producen células zonas hemorrágicas. Es un herpes virus se caracterizan por su alta sensibilidad a los desinfectantes, pueden establecer infecciones latentes porque periódicamente el virus puede reactivarse y ser diseminado.
- 104. DIAGNÓSTICO DIFERENCIAL • Coriza Infecciosa: Presencia de moco en fosas nasales, laringe y parte superior de tráquea (moco sanguinolento ausente). • Influencia Aviar/ Bronquitis infecciosa /New Castle: Presencia de tráqueas congestionadas sin formación de pseudomembranas. • Viruela Aviar: Presencia de pústulas en cavidad oral y esófago. Presencia de corpúsculos de inclusión intracitoplasmáticos
- 105. VACUNAS : VIVAS ATENUADAS • Efectivas para controlar brotes • Revierten a la virulencia • Producen infecciones latentes • Altamente transmisibles • Usadas en broiler ( 12-14 días) • Se pueden usar vía agua de bebida EMBRION DE POLLO (CEO)
- 106. VACUNA VECTORIZADA • No revierte a virulenta • Inocua • Evita la diseminación y latencia en el ave del virus de campo y vacunal • Adecuada duración de inmunidad
- 107. VACUNAS POR VECTORES Puntos en contra •Anticuerpos maternos a los genes insertados o a los vectores pueden inhibir el crecimiento del vector. •Pruebas de inocuidad toman mas tiempo (USDA) •Pruebas disponibles actualmente para evaluar la respuesta inmune pueden no detectar anticuerpos a la vacuna. Puntos a favor ▪ Inocuidad. ▪ No hay reversión a la virulencia. ▪ No hay diseminación del virus. ▪ No hay reacción vacunal. ▪ Se replican en el huésped (bajas dosis) ▪ Proteínas son procesadas en el huésped, por lo tanto las proteínas están en la forma correcta para ser protectoras. ▪ Eficacia y protección contra los agentes en la vacuna. ▪ Adecuada duración de la inmunidad.
- 108. TIPOS DE VACUNACIÓN Según el tipo de producción: ▪ Ponedoras: de origen de embrión de pollo (CEO), ▪ Pollos: de origen de cultivo de tejido (TCO), SPF: libres de agentes patogénicos específicos. COFAL: células de cultivo primario de fibroblasto de embriones.
- 109. Según el lugar de aplicación: ▪ Vacuna recombinante en la incubadora, ▪ Vacuna viva atenuada en el campo. Según el numero de ave: ▪ Vacunación masiva (agua, aerosol, en huevo), ▪ Vacunas individuales (gotas en los ojos, gotas nasales, cepillado de la cloaca, subcutánea, intramuscular). TIPOS DE VACUNACIÓN
- 110. Vacunación en huevo: Se utiliza 500 ml de diluyente/10.000 dosis de vacuna para administrar una dosis de| 0,05 ml por huevo.
- 111. PUNCIÓN ALAR: Insertar el aplicador en el pliegue del ala evitando las plumas, músculo, hueso y vasos sanguíneos (0.01 mL dosis/ave).
- 112. PUNCIÓN ALAR Con doble aplicador: -Pegar 2 lancetas -Aumentar la cantidad de diluyente: 1000 dosis=10ml de diluyente, doble lanceta incrementar el diluyente en un 50% = 15ml para 1000 dosis de vacuna
- 113. PUNCIÓN ALAR
- 114. PUNCIÓN ALAR
- 115. Perdido o no vacunado= sin nódulo % evaluación de 90% = aceptable, % evaluación de 95%= deseable 0= sin nódulo detectable 1= nódulo muy pequeño (< 2mm) 2= nódulo pequeño (2 – 5mm) 3= nódulo normal ( 5 – 10mm) 4= nódulo grande (> 10mm) EVALUACION DE NODULOS Y AREA DE INFLAMACION: PUNCIÓN ALAR
- 116. EVALUACION DE NODULOS Y AREA DE INFLAMACION: 6 días post -infección -Inmunidad es demostrada por mas de 37 semanas post- vacunación -Protección por mas de 60 semanas
- 118. INNOVAX ILT • Vacuna recombinante: ▪ (vector) de Marek (EM) y ▪ la laringotraqueitis infecciosa (LTI). Es una vacuna recombinante (vector) innovadora con virus del herpes del pavo (HVT) insertado con dos genes protectores de glucoproteína del virus de la LTI. + Gentamicina
- 119. INNOVAX ILT Vacunación: ▪ En embriones de pollo sanos de 18 días de incubación por vía en huevo, ▪ Vacunación de pollos sanos de un día de edad por vía subcutánea + Gentamicina
- 120. VECTORMUNE FP-LT • Vacuna recombinante: ▪ (vector) viruela aviary ▪ la laringotraqueitis infecciosa (LTI). El virus de la viruela aviar ha sido genéticamente modificado para expresar antígenos protectivos clave del virus de la Laringotraqueítis aviar (LT)
- 121. VECTORMUNE FP-LT Vacunación: Aplicación mediante punción en el ala de pollos sanos, susceptibles, de ocho semanas de edad o mayores, pero al menos 4 semanas antes de que las aves entren a postura -
- 122. VECTORVAC FP-LT Vacuna viva, recombinante: ▪ Viruela aviar y ▪ Laringotraqueítis aviar Contiene virus de Viruela Aviar vectorizada con gen glicoproteína B del virus de Laringotraqueítis Infecciosa.
- 123. VECTORVAC FP-LT Vacunación: Inyección intradérmica, en el pliegue alar con doble aguja acanalada, vacunación de aves sanas
- 124. TERAPIA COADYUVANTE Paracetamol: 100gr x cada kilo de peso en agua de bebida, Antiinflamatorio y analgésico. Yodo en el agua de bebida 0.5ml por litro ayuda en los procesos de cicatrización. Bromexina 0.5 ml a 1.0 ml por litro de agua de bebida, expectorante.
- 125. ANTIBIÓTICOTERAPIA Enrofloxacinas cada 12 horas durante 10 días a una dosis de 50 ml cada 100 litros de agua. Cloranfenicol: 20 mg / Kg por 3 á 5 días En infección bacteriana secundaria
- 126. PROFILAXIS Peróxido de hidrogeno En aspersiones en pisos y paredes desinfectante. Mantener una adecuada cuarentena y control de personal y eliminación de vectores, animales muertos y residuos de productos.