Semana 5
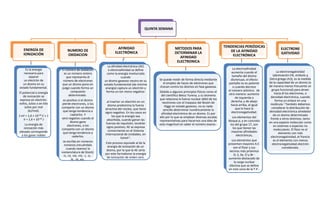
- 1. QUINTA SEMANA AFINIDAD METODOS PARA TENDENCIAS PERIÓDICAS ENERGÍA DE NUMERO DE ELECTRONE ELECTRÓNICA DETERMINAR LA DE LA AFINIDAD IONIZACIÓN OXIDACION GATIVIDAD AFINIDAD ELECTRÓNICA ELECTRONICA La afinidad electrónica (AE) Es la energía El número de oxidación o electroafinidad se define La electroafinidad necesaria para aumenta cuando el La electronegatividad es un número entero como la energía involucrada separar tamaño del átomo (abreviación EN, símbolo χ que representa el cuando un electrón de Se puede medir de forma directa mediante disminuye, el efecto (letra griega chi)), es la medida número de electrones un átomo gaseoso neutro en su un átomo en su el empleo de haces de electrones que pantalla no es potente de la capacidad de un átomo (o que un átomo pone en estado fundamental (de mínima estado fundamental. chocan contra los átomos en fase gaseosa. o cuando decrece de manera menos frecuente un juego cuando forma un energía) captura un electrón y el número atómico. de grupo funcional) para atraer El potencial o energía compuesto forma un ion mono negativo: Debido a algunos principios físicos como el otra manera: aumenta hacia él los electrones, o de ionización se determinado. . del científico Betoz Yurena, y su teorema de izquierda a densidad electrónica, cuando expresa en electrón- es positivo si el átomo que relaciona la fuerza nuclear débil de los forma un enlace en una al insertar un electrón en un neutrones con el traspaso del Bosón de derecha, y de abajo voltio, Julios o en kilo pierde electrones, o los hacia arriba, al igual molécula.1 También debemos átomo predomina la fuerza Higgs en estado gaseoso, no es nada Julios por mol comparte con un átomo que lo hace la considerar la distribución de atractiva del núcleo, que tiene sencillo determinar numéricamente la (kJ/mol). que tenga tendencia a electronegatividad. densidad electrónica alrededor signo negativo. En los casos en afinidad electrónica de un átomo. Es por 1 eV = 1,6 × 10-19 C × 1 captarlos. Y los que la energía sea de un átomo determinado será negativo cuando el ello por lo que se emplean diversas escalas Los elementos del frente a otros distintos, tanto V = 1,6 × 10-19 J absorbida, cuando ganan las representativas para hacernos una idea de bloque p, y en concreto átomo gane fuerzas de repulsión, tendrán en una especie molecular como La energía de electrones, o los esta magnitud sin saber el número exacto.. los del grupo 17, son en sistemas o especies no ionización más signo positivo; AE se expresa los que tienen las comparta con un átomo comúnmente en el Sistema moleculares. El flúor es el elevada corresponde que tenga tendencia a mayores afinidades elemento con más a los gases nobles Internacional de Unidades, en electrónicas, cederlos. kJmol-1. electronegatividad, el francio se escribe en números Los elementos que es el elemento con menos Este proceso equivale al de la presentan mayores A.E. electronegatividad.electrón romanos (recuérdalo energía de ionización de un cuando veamos la son el flúor y sus considerado. átomo, por lo que la AE sería vecinos más próximos nomenclatura de Stock): por este formalismo la energía +I, +II, +III, +IV, -I, -II, - O, S, Se, Cl y Br - de ionización de orden cero. aumento destacado de III, -IV, etc. la carga nuclear efectiva que se define en esta zona de la T.P.-