Semana 7
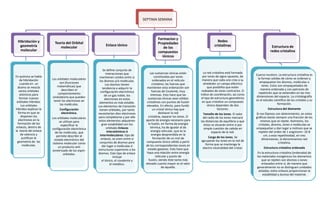
- 1. SEPTIMA SEMANA Formacion y Hibridación y Teoria del Orbital Redes Enlace iónico Propiedades geometría molecular cristalinas Estructura de de los molecular compuestos redes cristalina iónicos Se define conjunto de interacciones que Las sustancias iónicas están La red cristalina está formada por iones de signo opuesto, de Cuarzo incoloro. La estructura cristalina es En química se habla mantienen unidos entre sí constituidas por iones Los orbitales moleculares manera que cada uno crea a su la formas solidas de cómo se ordenan y de hibridación los átomos y/o moléculas. ordenados en el retículo son (funciones alrededor un campo eléctrico empaquetan los átomos, moléculas o cuando en un Los átomos tienen cristalino; las fuerzas que matemáticas) que que posibilita que estén iones. Estos son empaquetados de átomo se mezcla tendencia a adquirir la mantienen esta ordenación son describen el rodeados de iones contrarios. El manera ordenada y con patrones de varios orbitales configuración electrónica fuerzas de Coulomb, muy comportamiento índice de coordinación, así como repetición que se extienden en las tres atómicos para de un gas noble, los intensas. Esto hace que las ondulatorio que pueden el tipo de estructura geométrica dimensiones del espacio. La cristalografía formar nuevos electrones en estos sustancias iónicas sean sólidos tener los electrones en en que cristalice un compuesto es el estudio científico de los cristales y su orbitales híbridos. elementos es más estable. cristalinos con puntos de fusión las moléculas. iónico dependen de dos formación. Los orbitales Los elementos de transición elevados. En efecto, para fundir híbridos explican la Configuración tienen orbitales, por tanto un cristal iónico hay que factores: Estructura del diamante forma en que se electrónica. necesitarían diez electrones deshacer la red Tamaño de los iones. El valor Si nos fijamos con detenimiento, en estos disponen los para completarse y por ello cristalina, separar los iones. El del radio de los iones marcará gráficos existe siempre una fracción de los Los orbitales moleculares electrones en la estos elementos adquieren aporte de energía necesario para las distancias de equilibrio a que mismos que se repite. Asimismo, los se utilizan para formación de los gran estabilidad con los la fusión, en forma de energía éstos se situarán entre sí por cristales, átomos, iones o moléculas se especificar la enlaces, dentro de orbitales Enlaces térmica, ha de igualar al de simple cuestión de cabida en empaquetan y dan lugar a motivos que se configuración electrónica la teoría del enlace interatómicos ó energía reticular, que es la espacio de la red. repiten del orden de 1 angstrom= 10-8 de las moléculas, que de valencia y intermoleculares: tipo de energía desprendida en la cm; a esta repetitividad, en tres permite describir el Carga de los iones. Se justifican la enlaces, se unen entre sí formación de un mol de dimensiones, la denominamos red estado electrónico del agruparán los iones en la red de geometría de las conjuntos de átomos para compuesto iónico sólido a partir cristalina. sistema molecular como forma que se mantenga la moléculas. dar lugar a moléculas ó de los correspondientes iones en un producto anti electro neutralidad del cristal. Estructura cristalina ordenada simetrizado de los espín- estructuras superiores a los estado gaseoso. Esto hace que orbitales. átomos. Este tipo de enlace haya una relación entre energía En la estructura cristalina (ordenada) de incluye reticular y punto de los materiales inorgánicos los elementos el iónico, el covalente y fusión, siendo éste tanto más que se repiten son átomos o iones el metálico. elevado cuanto mayor es el valor enlazados entre sí, de manera que de aquella. generalmente no se distinguen unidades aisladas; estos enlaces proporcionan la estabilidad y dureza del material.