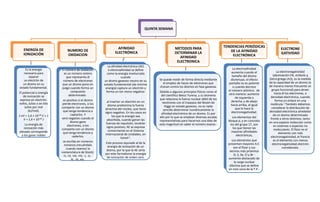
La quinta semana trata sobre conceptos relacionados con la afinidad electrónica y la electronegatividad de los átomos. La afinidad electrónica es la energía involucrada cuando un átomo neutro captura un electrón formando un ion negativo. Puede medirse directamente usando haces de electrones. La electronegatividad mide la capacidad de un átomo para atraer electrones cuando forma enlaces, y es mayor para elementos pequeños de la izquierda de la tabla periódica como el flúor.