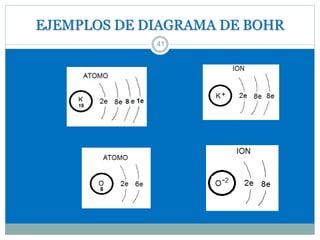
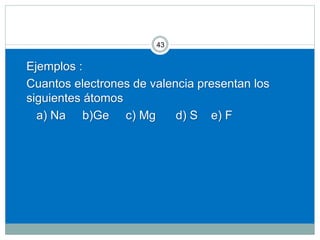
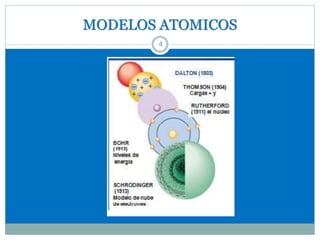
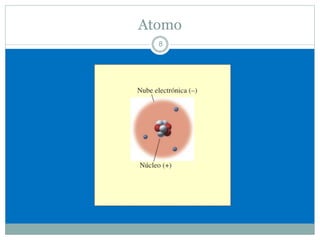
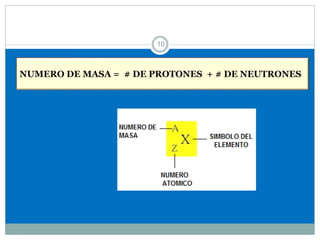
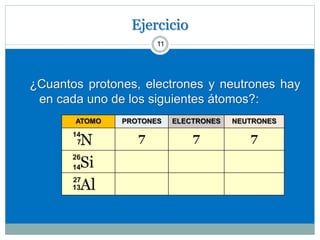
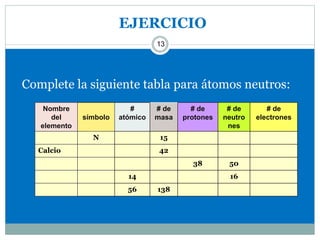
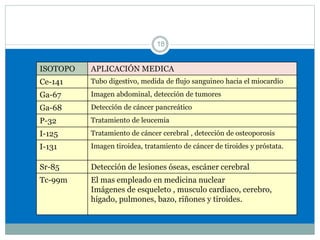
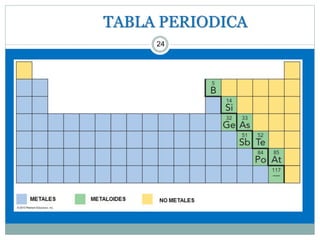
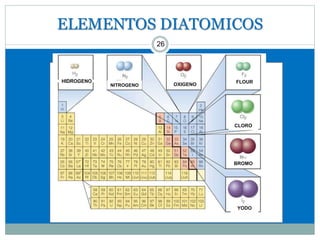
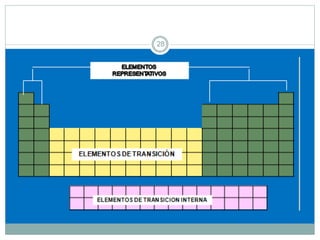
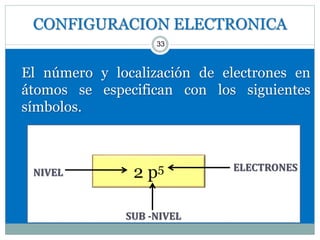
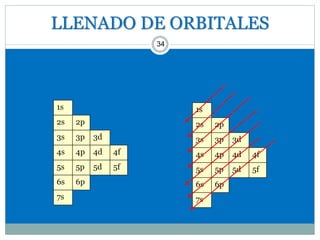
Este documento presenta información sobre la estructura atómica y la tabla periódica. Explica conceptos clave como átomo, teoría atómica de Dalton, partículas subatómicas, modelos atómicos, número atómico, número de masa, isótopos, configuración electrónica y la organización de los elementos en la tabla periódica. También cubre temas como iones, diagramas de Bohr y electrones de valencia.






















![CONFIGURACIÓN ELECTRÓNICA
38
ABREVIADA
Se coloca en corchetes el símbolo del gas noble del
periodo anterior al elemento del que se va escribir
la configuración electrónica y luego se colocan los
electrones que faltan.
Ejemplo: Oxigeno (O)
[He] 2s22p4](https://image.slidesharecdn.com/1estructuraatmicapresentacin-221120205156-2464f4e2/85/1Estructura-atomica-Presentacion-ppt-38-320.jpg)