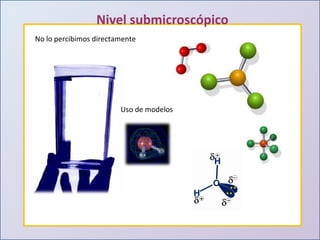
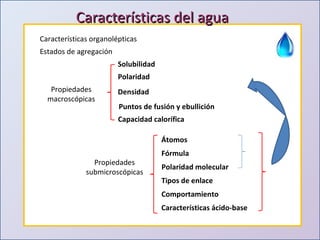
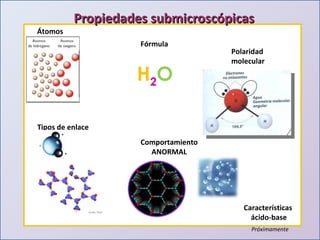
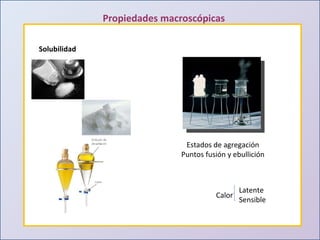
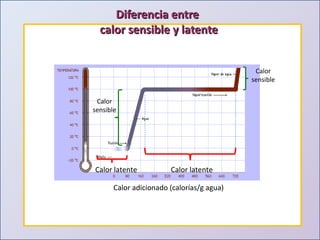
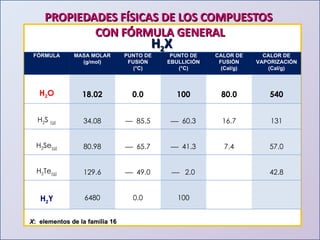
Este documento presenta una introducción al estudio del agua y sus propiedades químicas. Explica que se discutirán temas como la disponibilidad del agua, contaminación, importancia para la vida y más. También describe los tres niveles de representación del agua: macroscópico, submicroscópico y simbólico. Finalmente, proporciona una tabla con las propiedades físicas de compuestos con la fórmula general H2X.