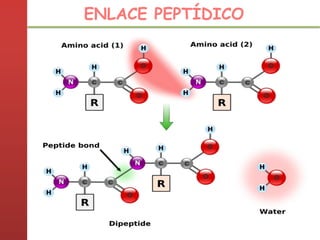
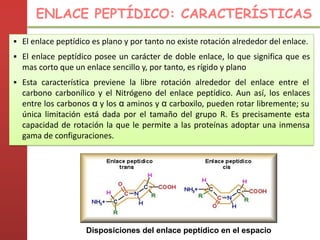
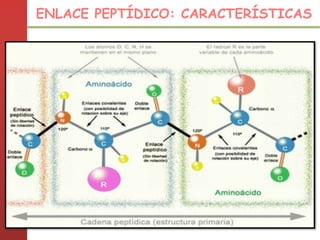
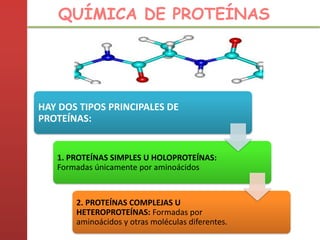
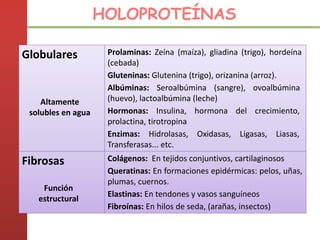
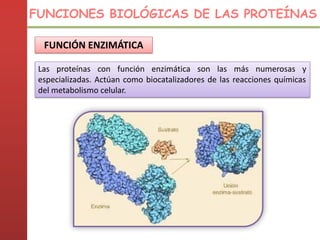
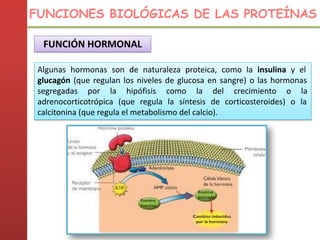
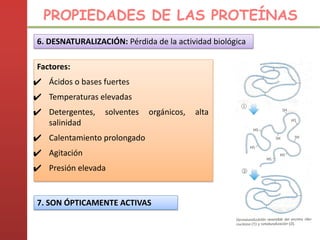
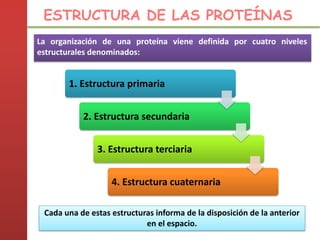
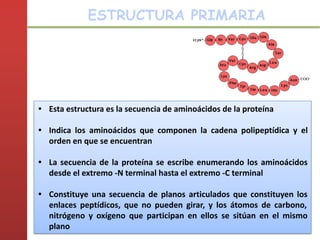
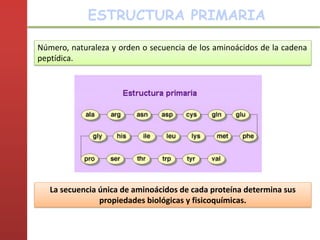
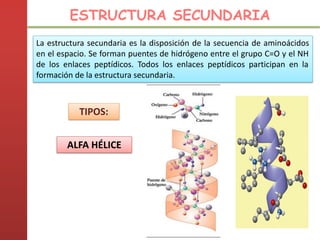
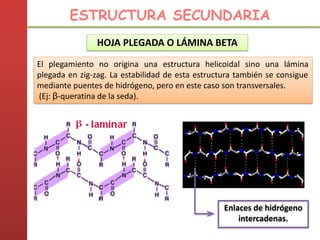
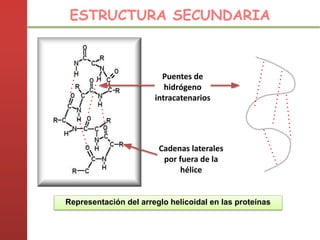
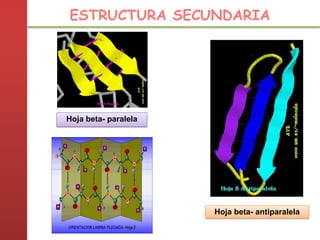
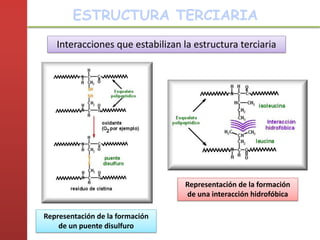
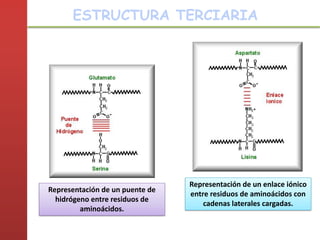
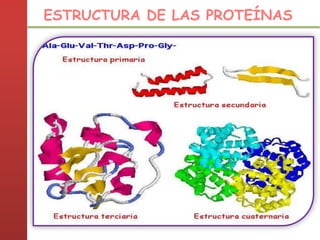
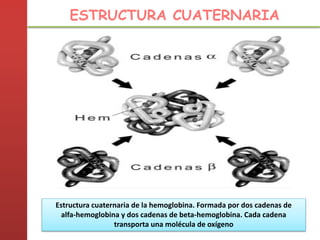
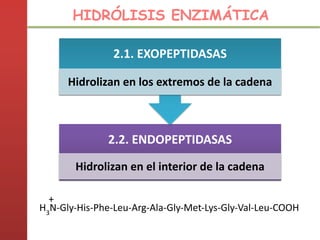
1. Las proteínas están compuestas principalmente por carbono, hidrógeno, oxígeno y nitrógeno. 2. Están formadas por bloques estructurales llamados aminoácidos unidos por enlaces peptídicos. 3. Las proteínas tienen cuatro niveles de estructura: primaria, secundaria, terciaria y cuaternaria, que determinan su forma tridimensional y función.